Chemia organiczna
Jacek Młynarski
Zakład Chemii Organicznej
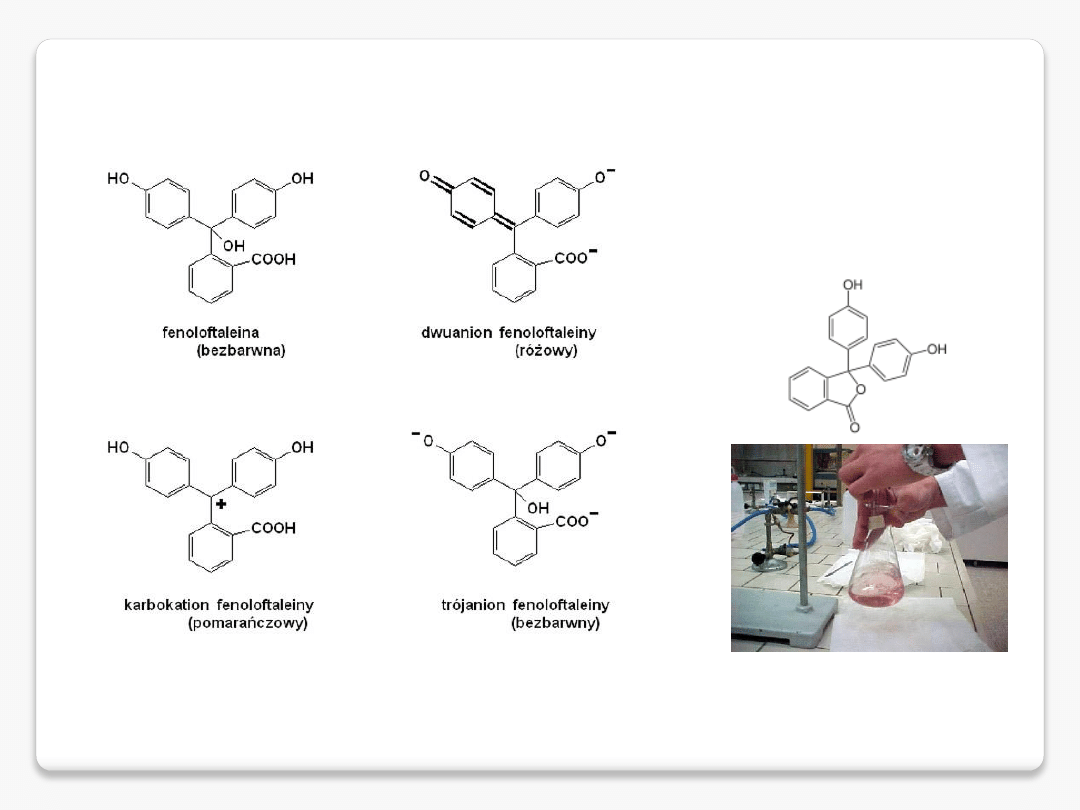
fenoloftaleina
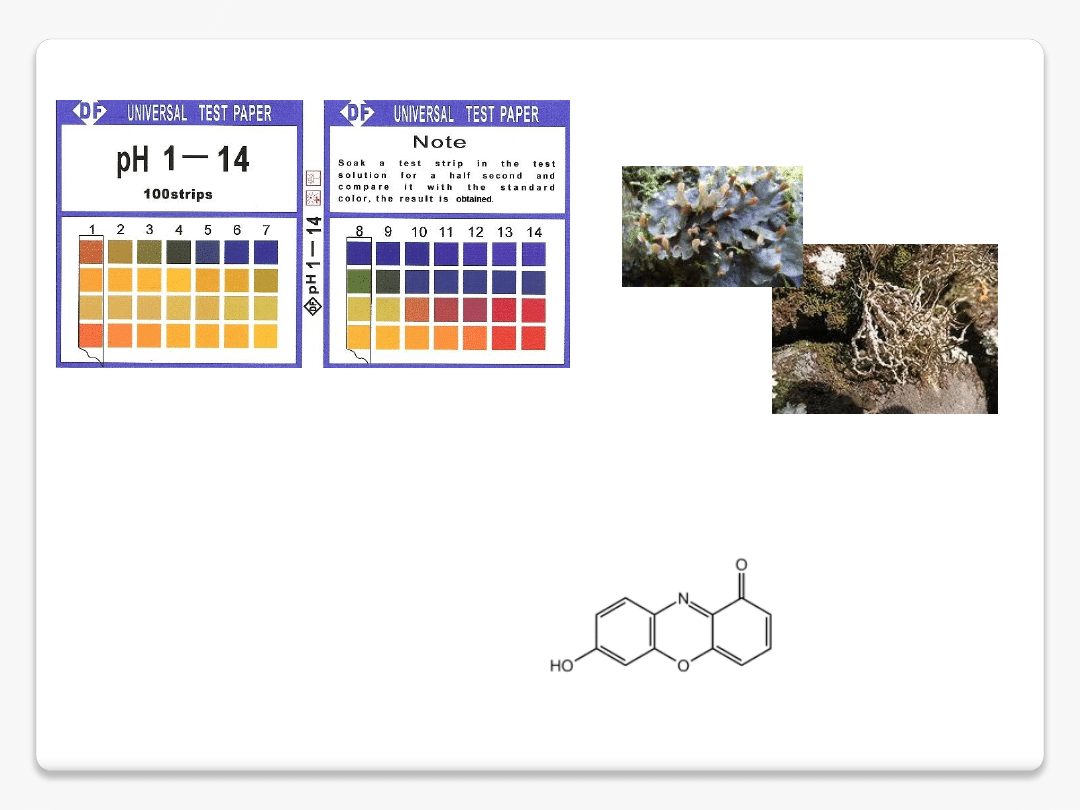
lakmus
Lakmus (E121)
– wskaźnik pH, produkt naturalny występujący w wielu gatunkach porostów, m.in. Roccella fuciformis,
występujących u wybrzeży Morza Śródziemnego i Oceanu Atlantyckiego.
Mieszanina rozpuszczalnych w wodzie
barwników (w tym azolitminy), Składniki odpowiedzialne za zmiany barwy
lakmusu
zawierają chromofor 7-hydroksyfenoksazonowy
konserwanty
E260
E280
E210
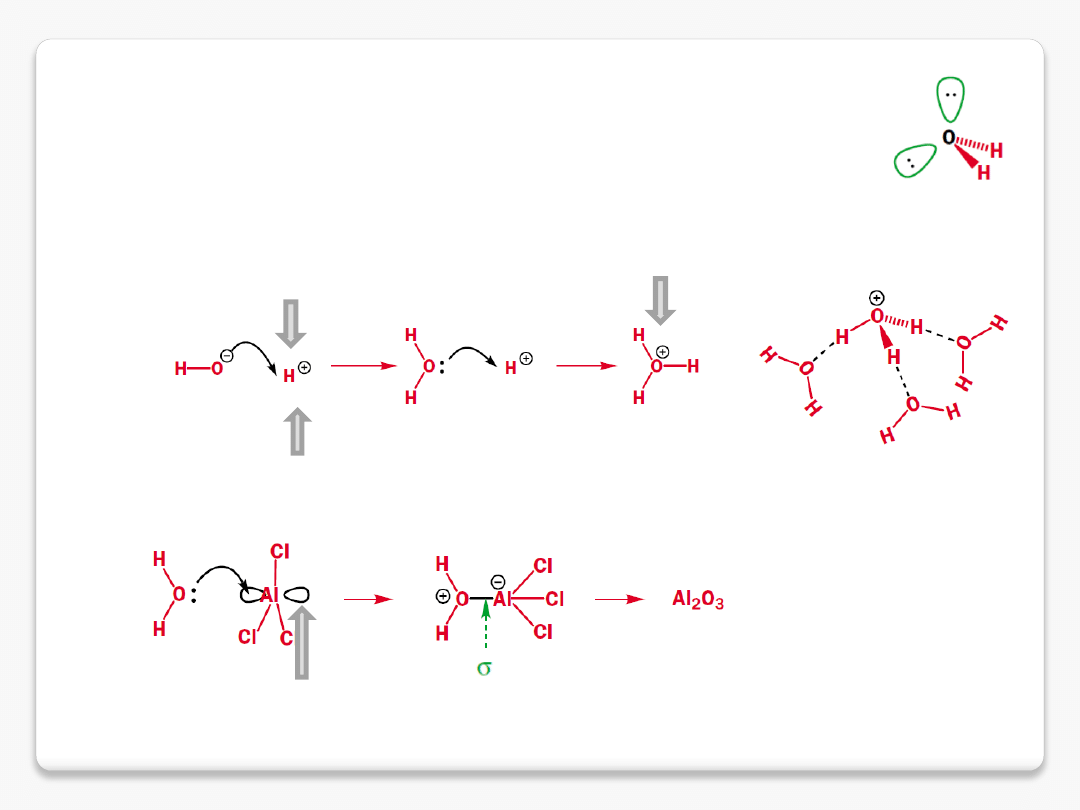
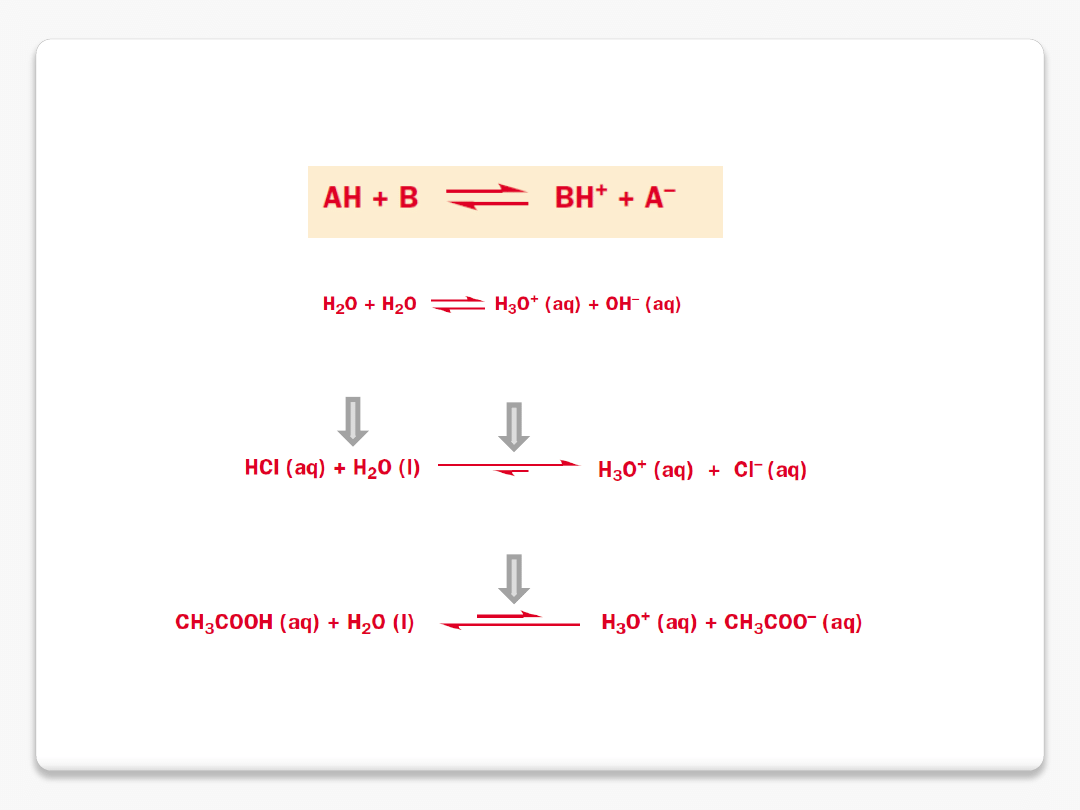
kwasy i zasady
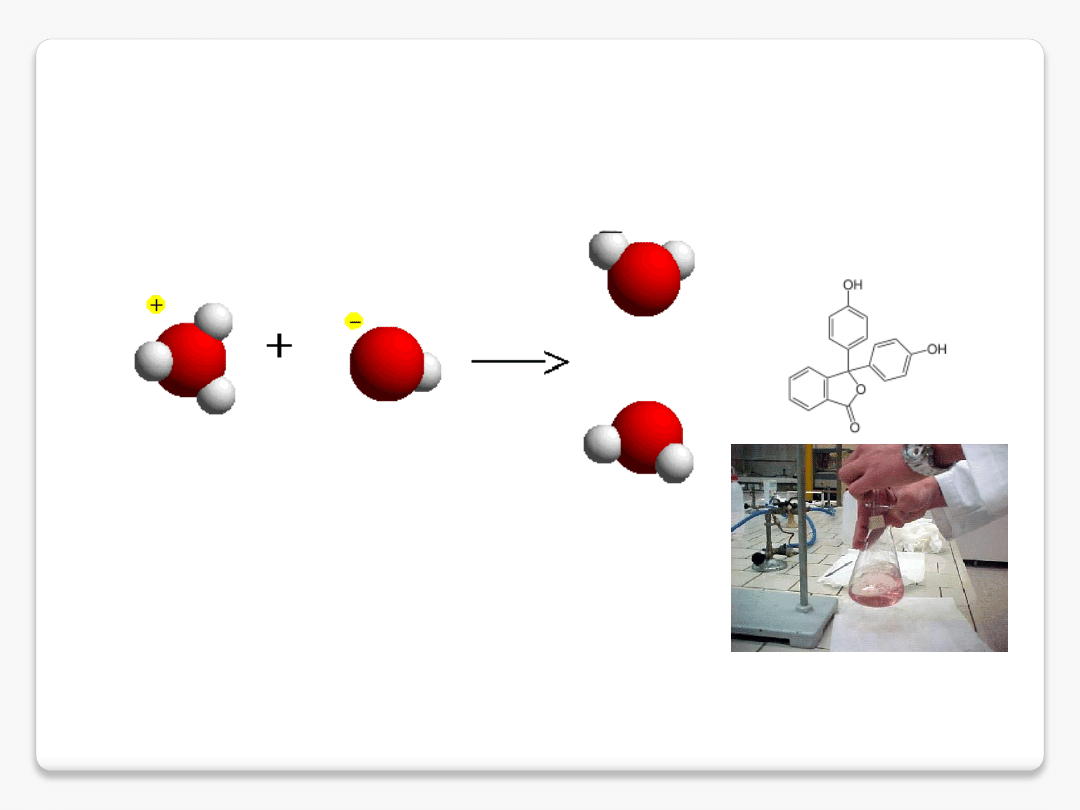
kwas Brønsteda
(kwas protonowy, np. HCl)
proton
pusty orbital p
kation hydroniowy
(czasem: jon oksoniowy)
kwas Brønsteda – skłonność do utraty protonu
zasada Brønsteda – skłonność do przyłączenia protonu
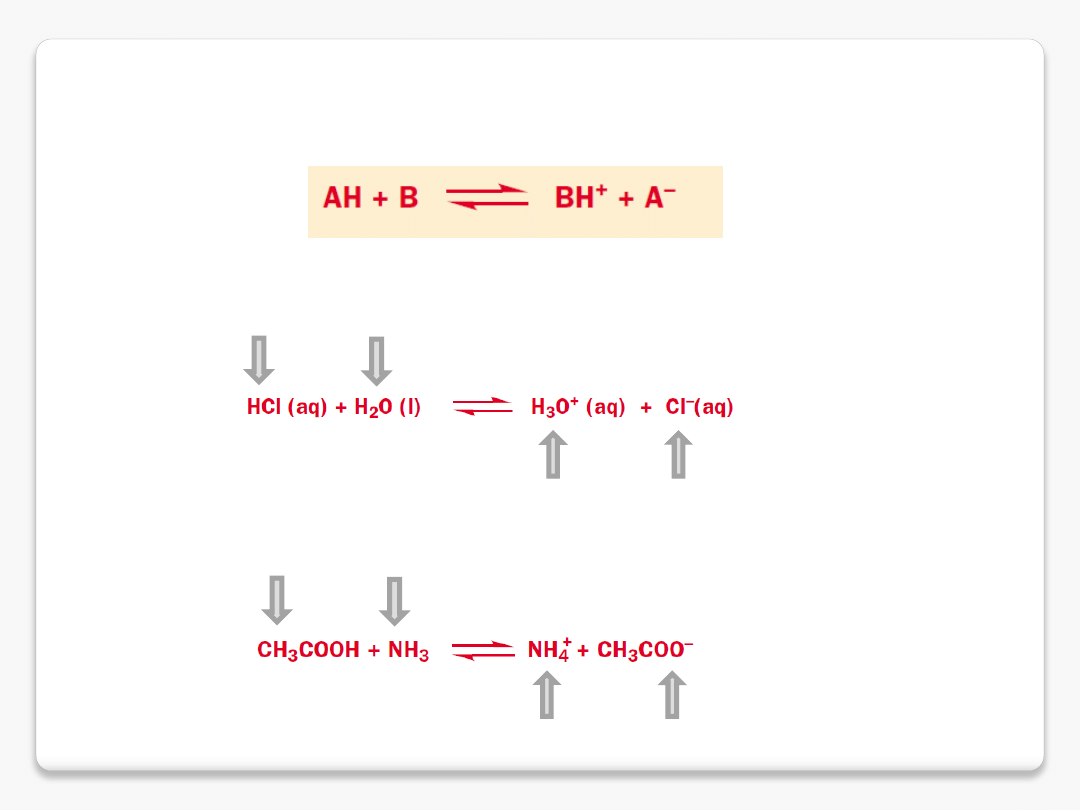
sprzężone kwasy i zasady
kwas
kwas
zasada
zasada
kwas
kwas
zasada
zasada
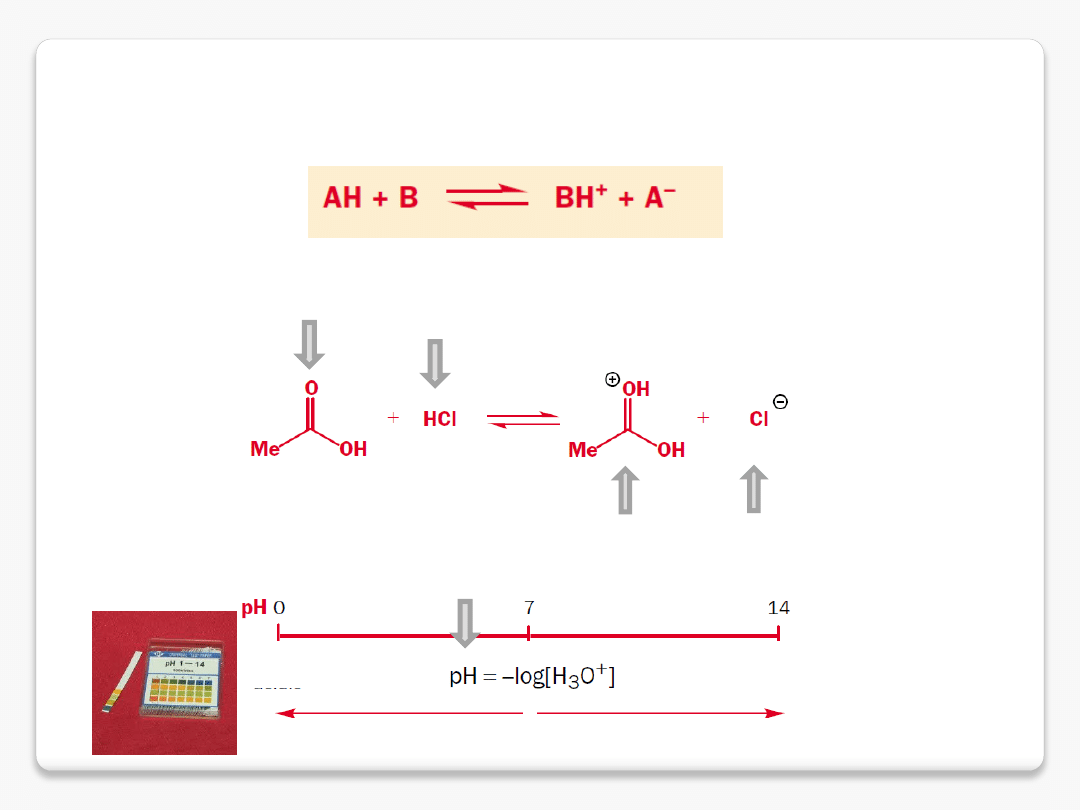
kwas vs. zasada
związki amfoteryczne
kwas
kwas
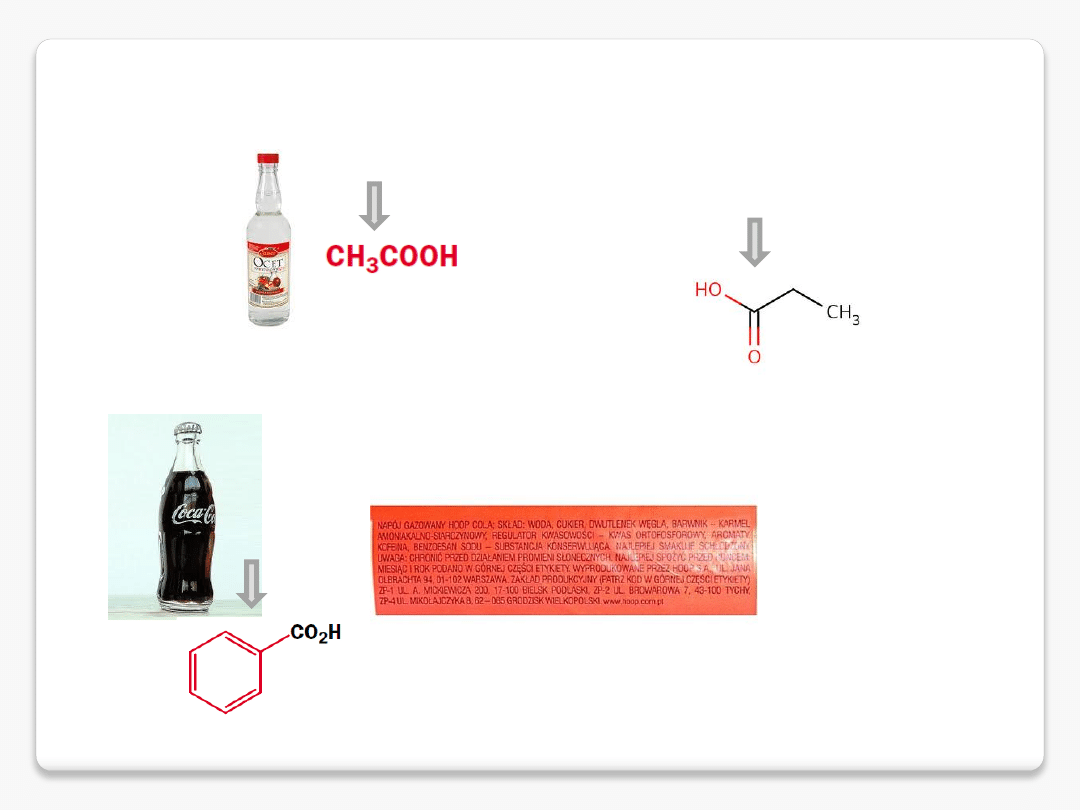
kwas octowy
zasada
zasada
wzrost mocy kwasu
stężenie jonów hydroniowych w roztworze
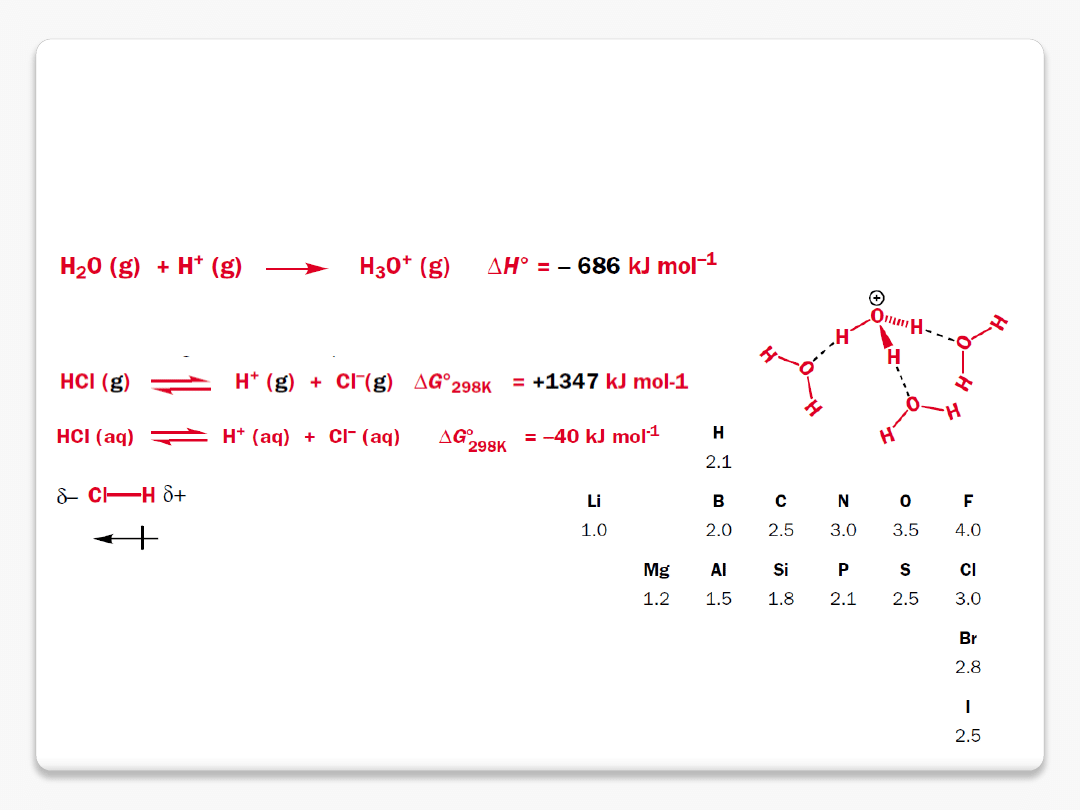
mocne i słabe kwasy
pH wyższe (ca. 1)
pH niższe (ca. 3.5)
woda po dodaniu mocnego kwasu
zachowuje się jak zasada

mocne i słabe kwasy
im mniejsze jest pK
a
, tym większa jest stała K
a
, a więc tym
mocniejszy kwas
pK
a
kwasu jest równe jego pH, gdy jest on dokładnie w połowie zdysocjowany
gdy pH jest większe of pK
a
, kwas HA występuje w wodzie w postaci A

mocne i słabe kwasy
moc kwasu zależy od trwałości sprzężonej zasady
im mocniejszy kwas tym słabsza sprzężona z nim zasada
im mocniejszy kwas tym słabsza
sprzężona z nim zasada
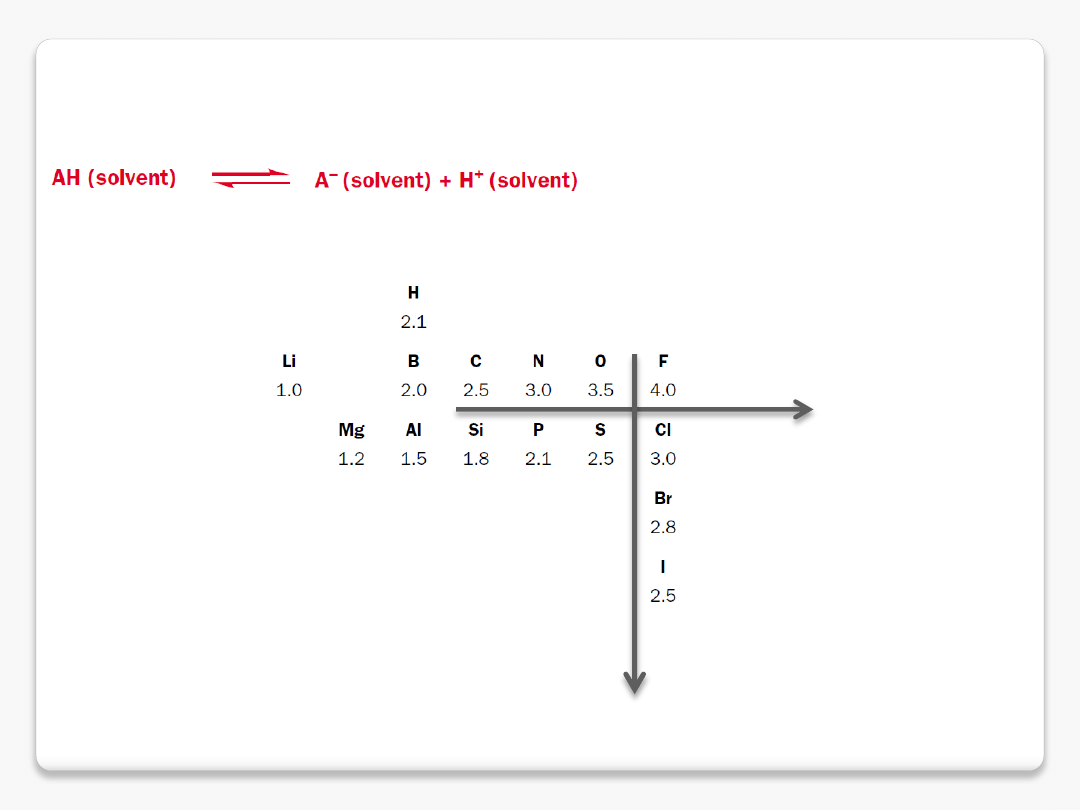
mocne i słabe kwasy
rozpuszczalność w wodzie
związki nierozpuszczalne w wodzie
mocne i słabe kwasy
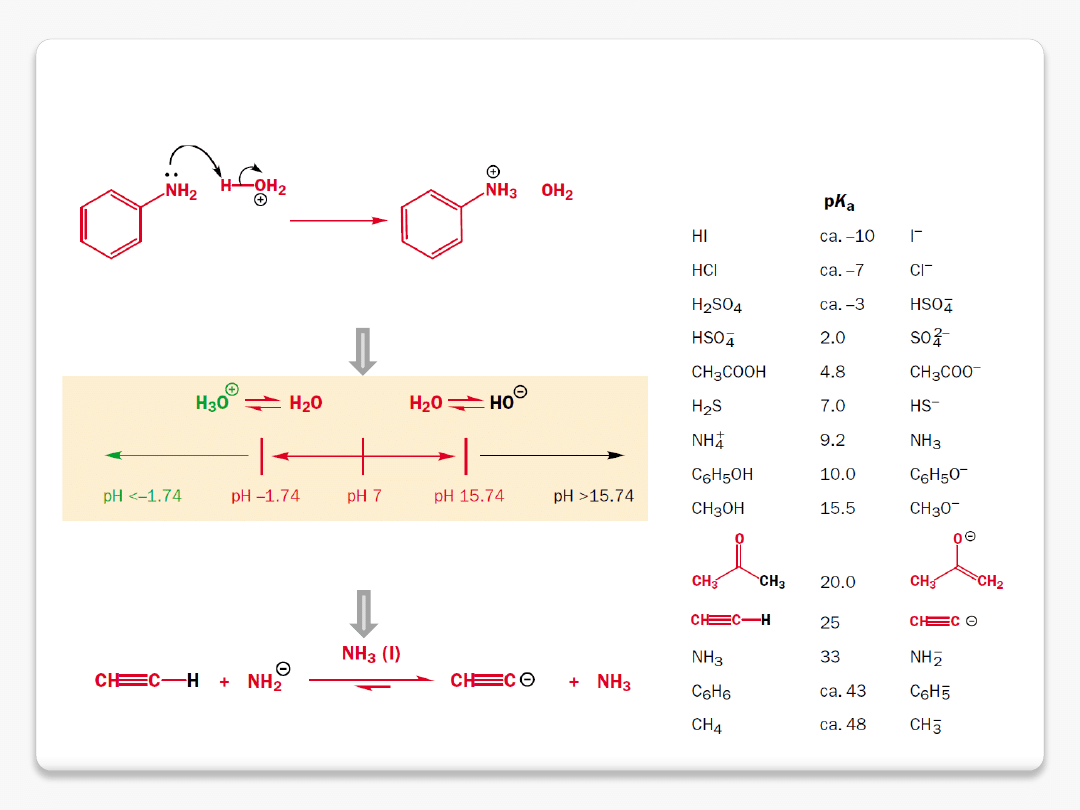
protonowanie i deprotonowanie – wybór rozpuszczalnika
pK
a
wody 15.74
pK
a
amoniaku 33
najsilniejszy kwas
w wodzie
najsilniejsza zasada
w wodzie
mocne i słabe kwasy
im trwalsza sprzężona zasada tym mocniejszy kwas
ujemny ładunek na
elektroujemnym atomie
stabilizuje sprzężoną zasadę
słabsze wiązania A-H czynią
kwasy mocniejszymi
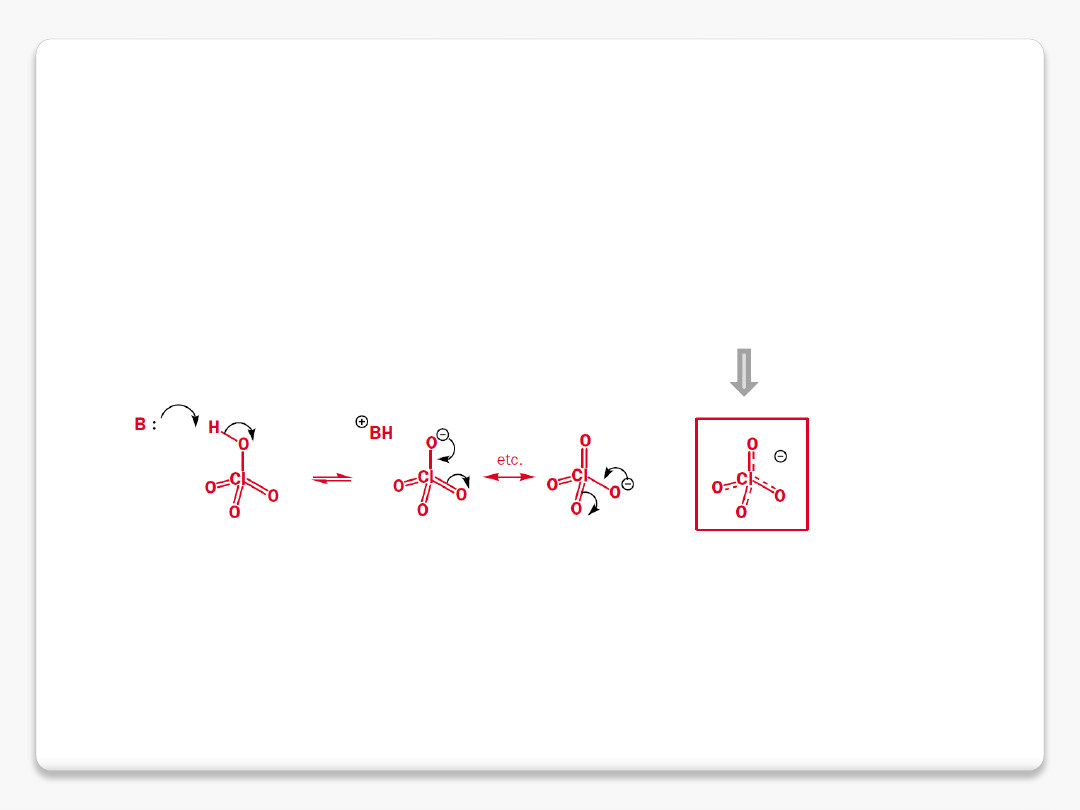
mocne i słabe kwasy
im trwalsza sprzężona zasada tym mocniejszy kwas
delokalizacja ładunku ujemnego w
kwasie nadchlorowym stabilizuje
sprzężoną zasadę
HClO
7.5
HClO
2
2
HClO
3
-1
HClO
4
-10
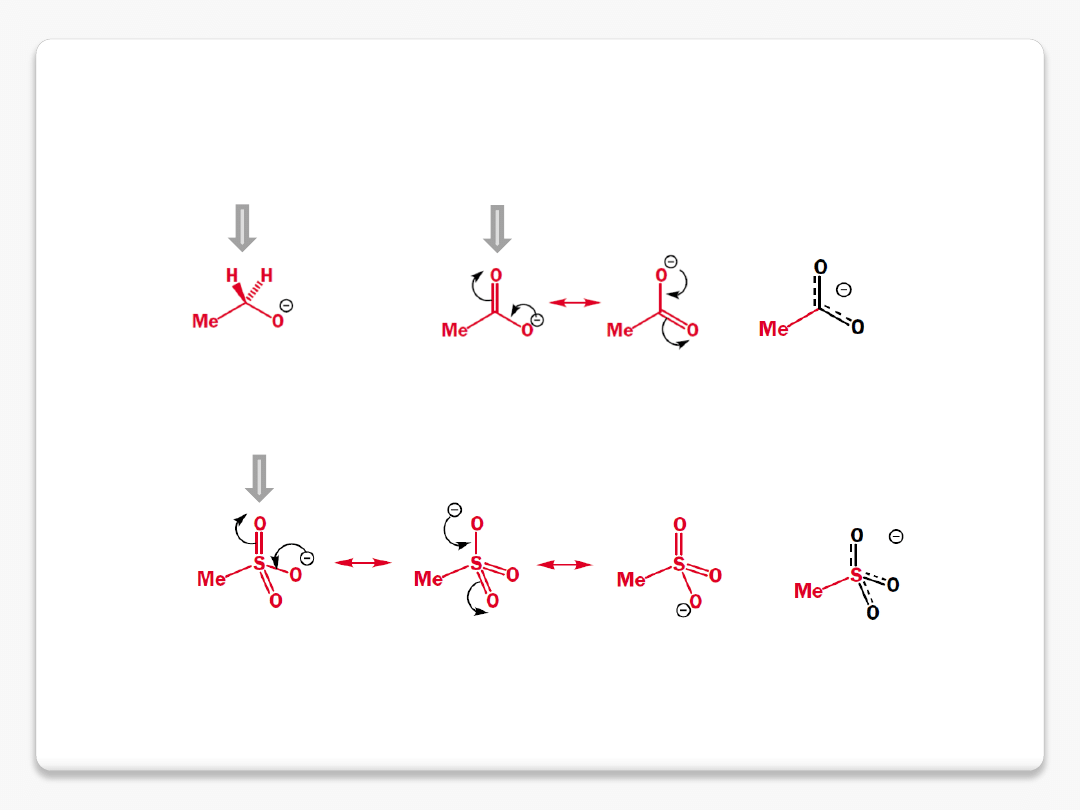
delokalizacja ładunku ujemnego
etanol pK
a
15.9
kwas octowy pK
a
4.8
kwas metanosulfonowy pK
a
-1.9
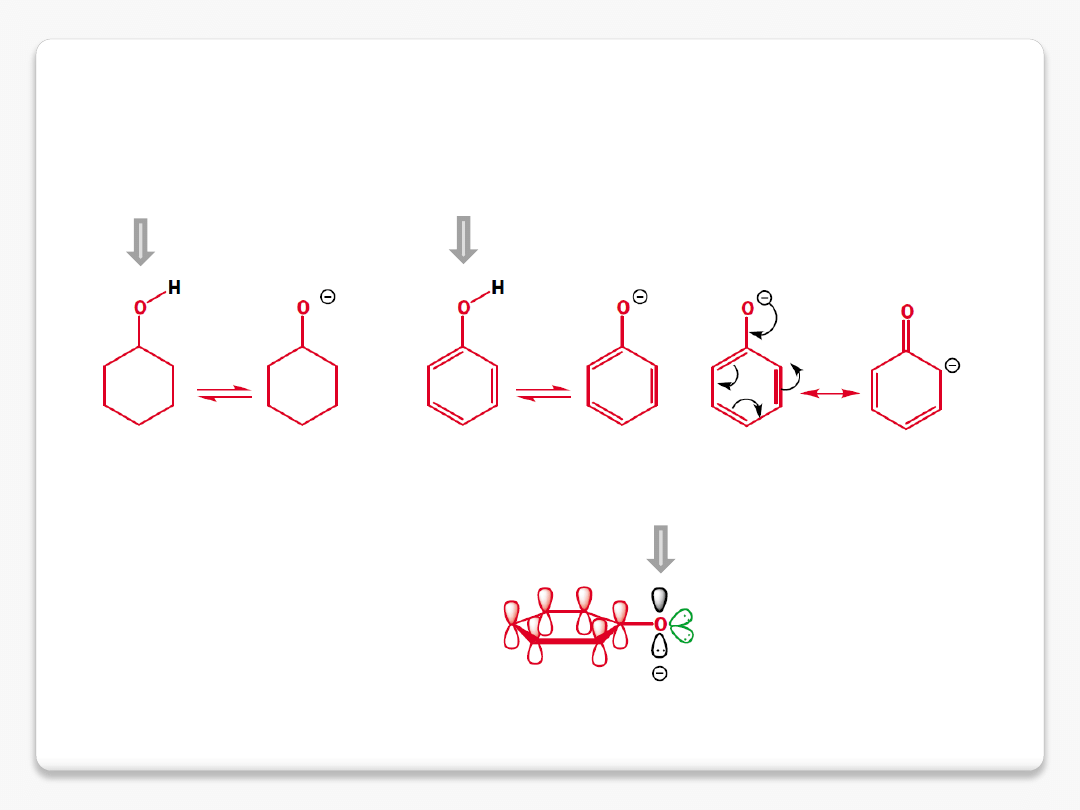
delokalizacja ładunku ujemnego
cyklohksanol pK
a
16
fenol pK
a
10
nakładanie z układem
elektronów
p
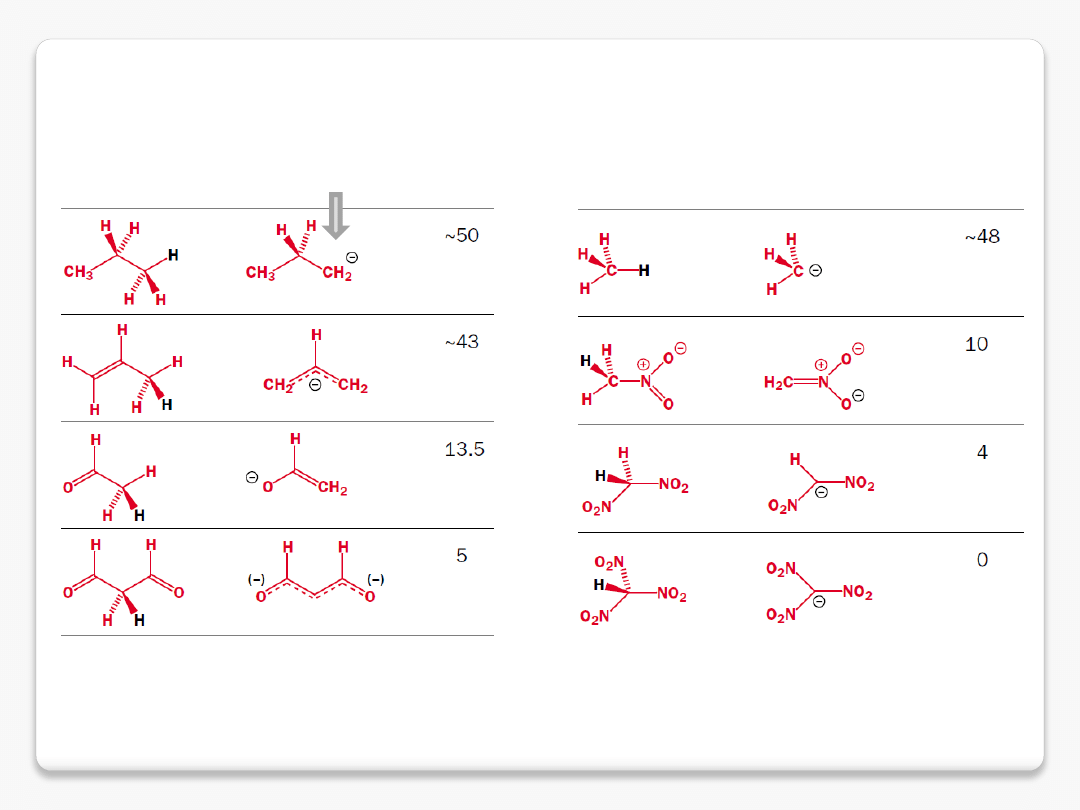
delokalizacja ładunku ujemnego
dla C-H kwasów
ładunek zlokalizowany na jednym atomie węgla, niekorzystnie z powodu
niewielkiej elektroujemności węgla
delokalizacja na układzie
p
i
elektroujemnych atomach tlenu
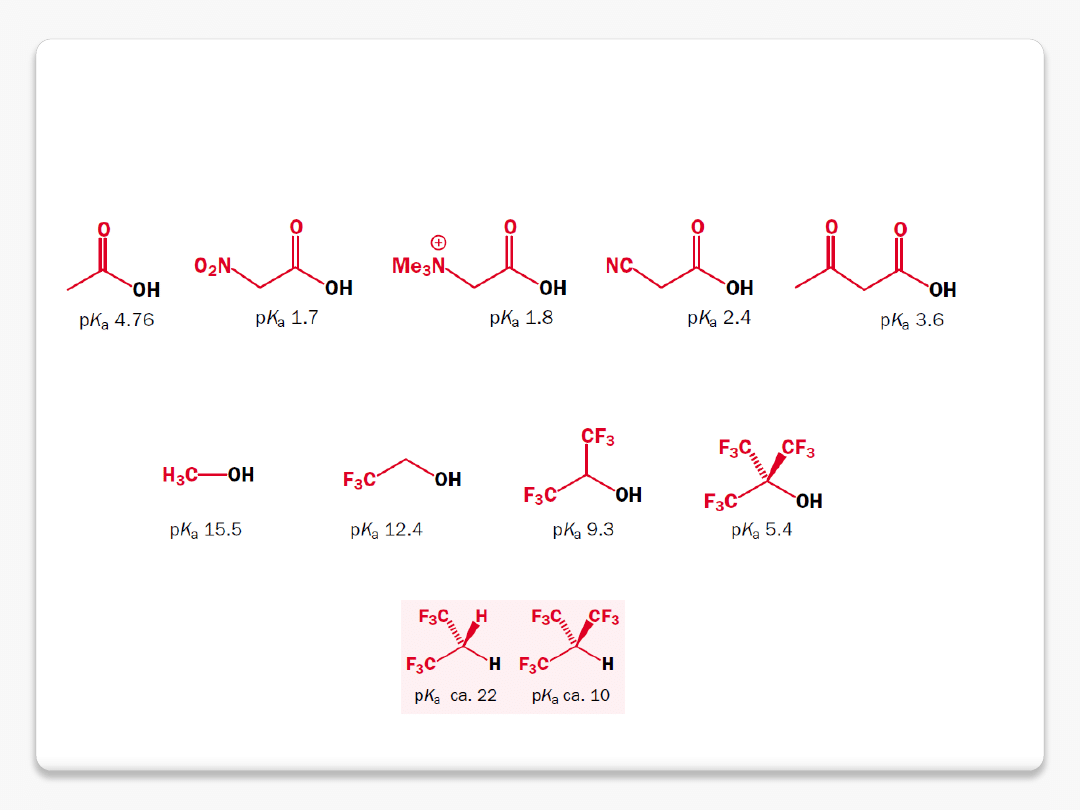
efekt grup elektronoakceptorowych
rozproszenie ładunku bez sprzężenia
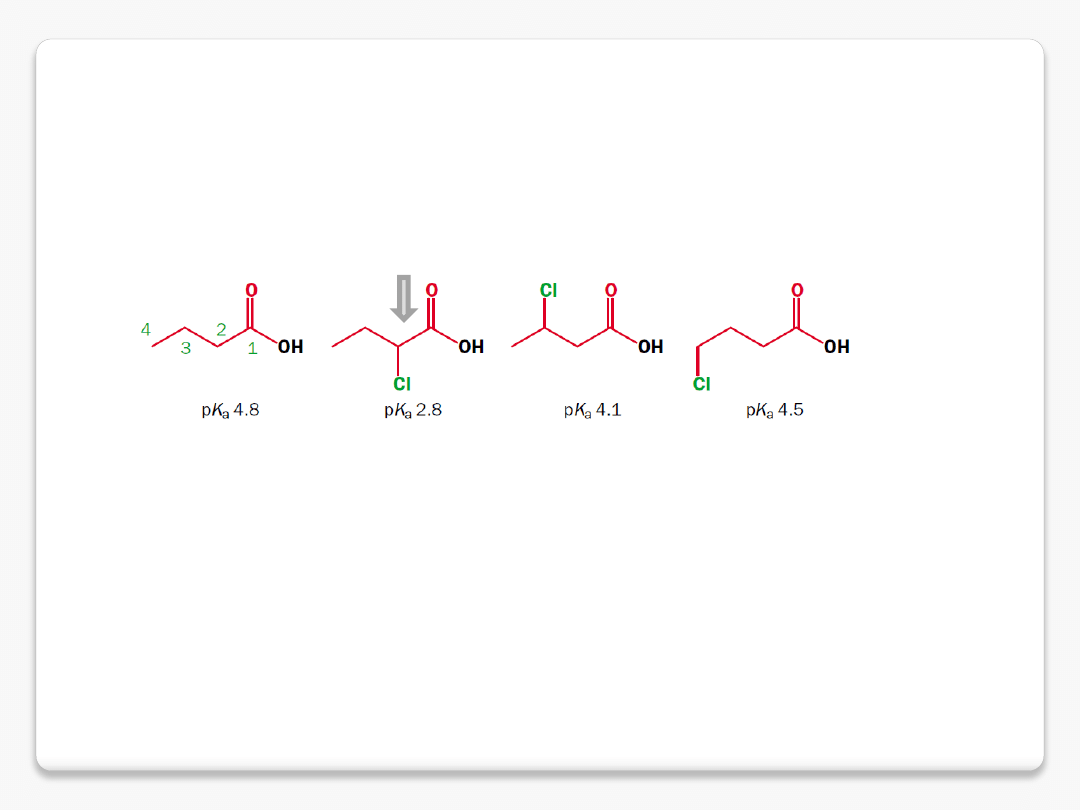
efekt grup elektronoakceptorowych
efekt indukcyjny
polaryzacja wiązania
s
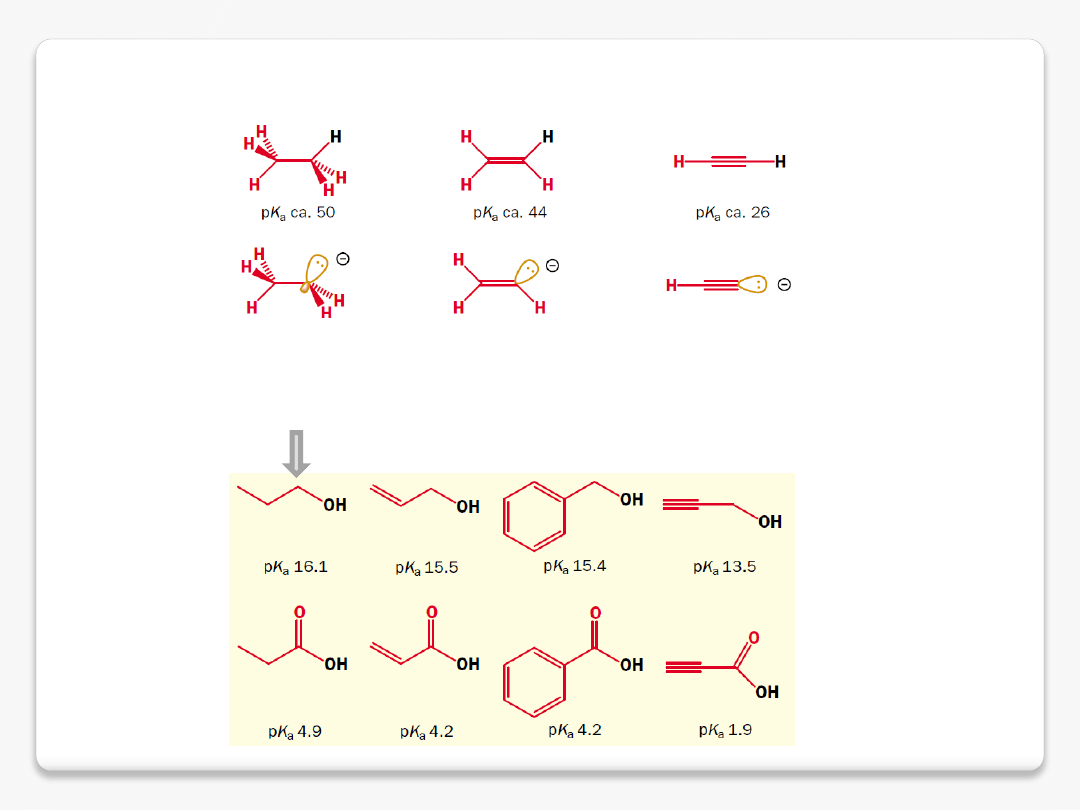
wpływ hybrydyzacji
w im większym stopniu orbital ma charakter orbitalu s, tym bardziej utrzymuje
na sobie elektrony – atom o hybrydyzacji sp jest mniej elektronodonorowy
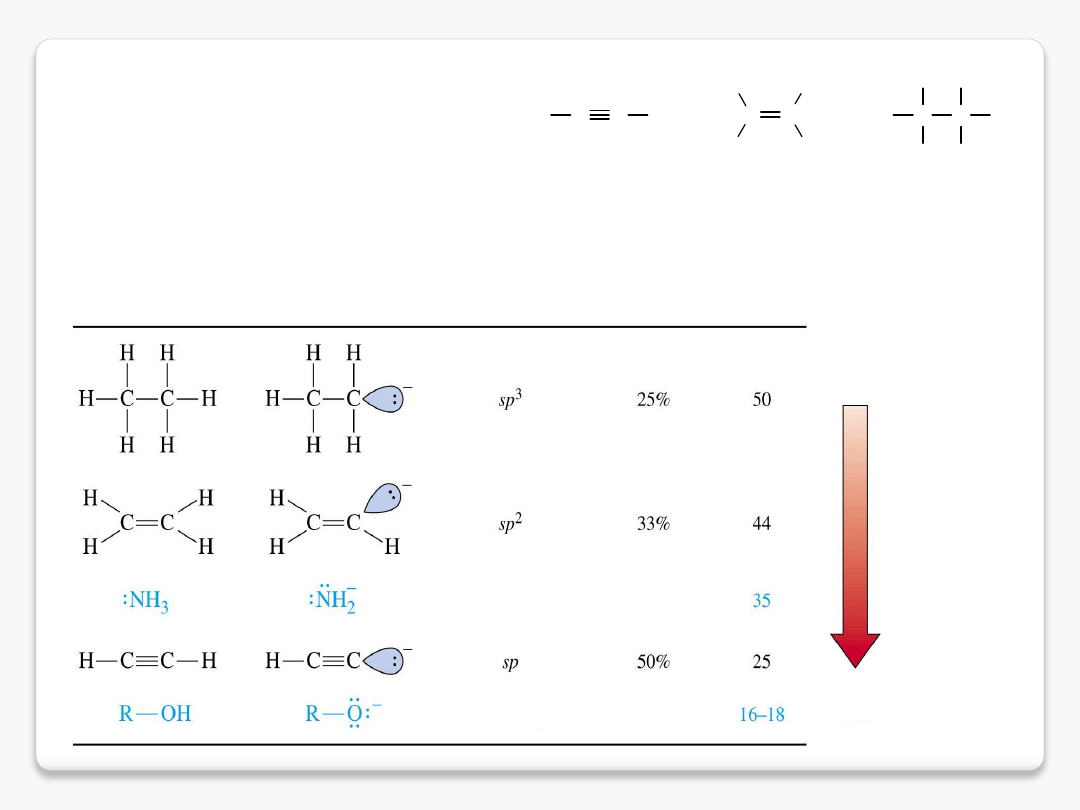
wpływ hybrydyzacji
H
C
C
H
C
C
H
H
H
H
H
C
C
H
H
H
H
H
pK
a
= 25
pK
a
= 44
pK
a
= 50
silniejszy
kwas
słabszy
kwas
kwas
sprzężona zasada
udział orbitalu s
pK
a
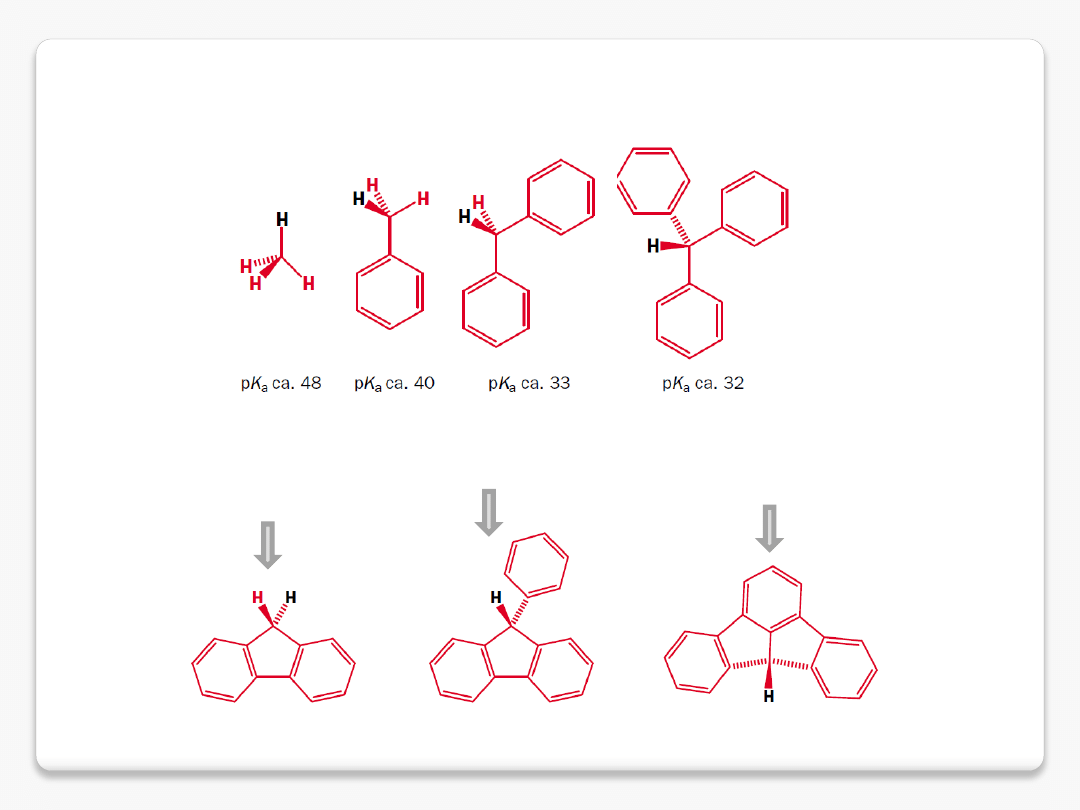
sprzężone C-H kwasy
fluoren pK
a
22.8
9-fenylofluoren pK
a
18.5
fluoraden pK
a
11
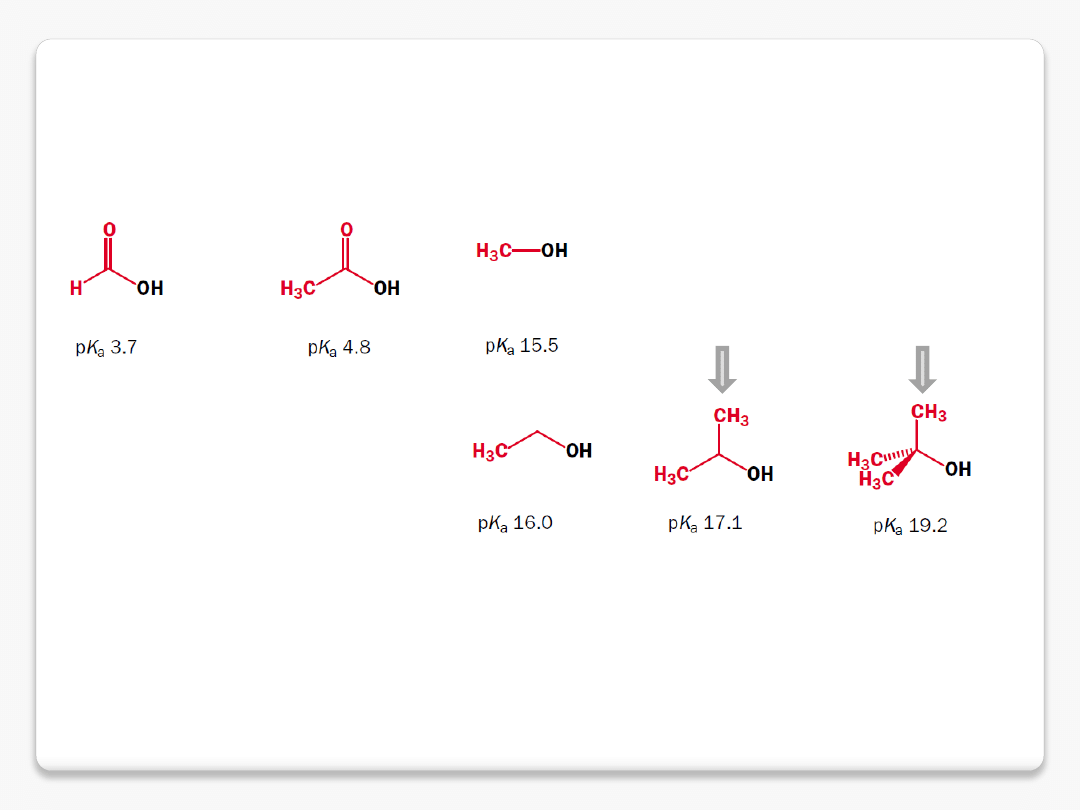
efekt grup elektronodonorowych
grupy alkilowe uwalniają elektrony
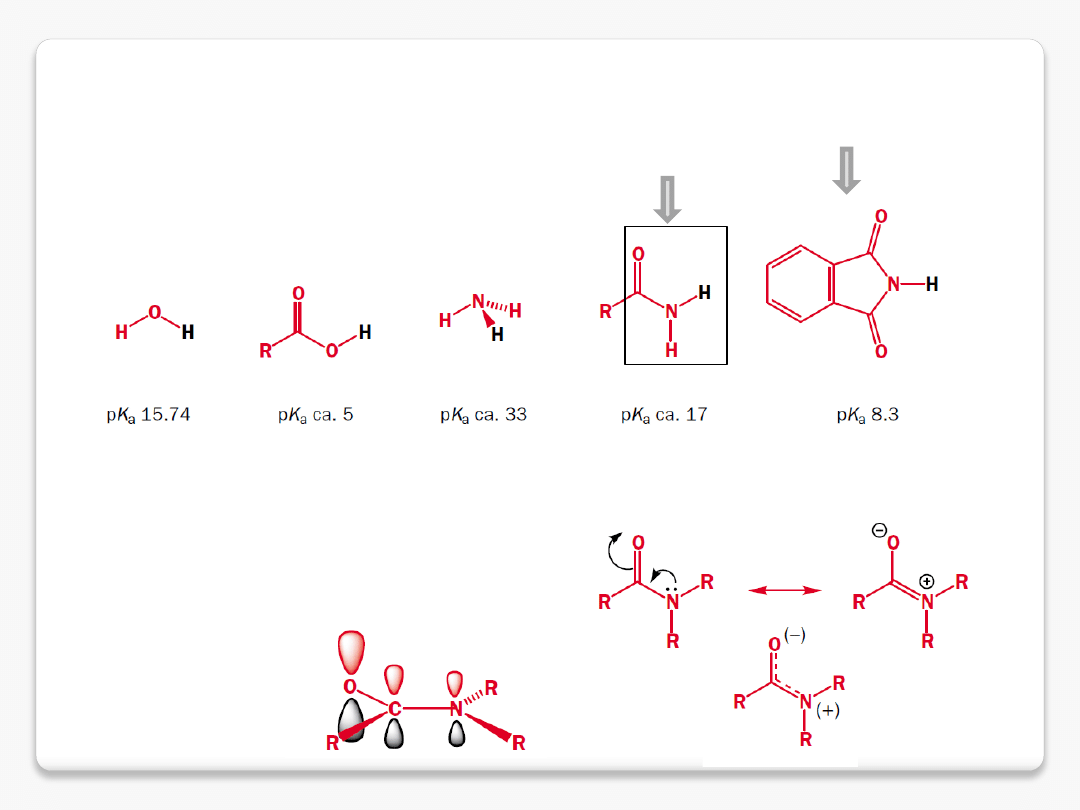
N-H kwasy
grupa amidowa
ftalimid
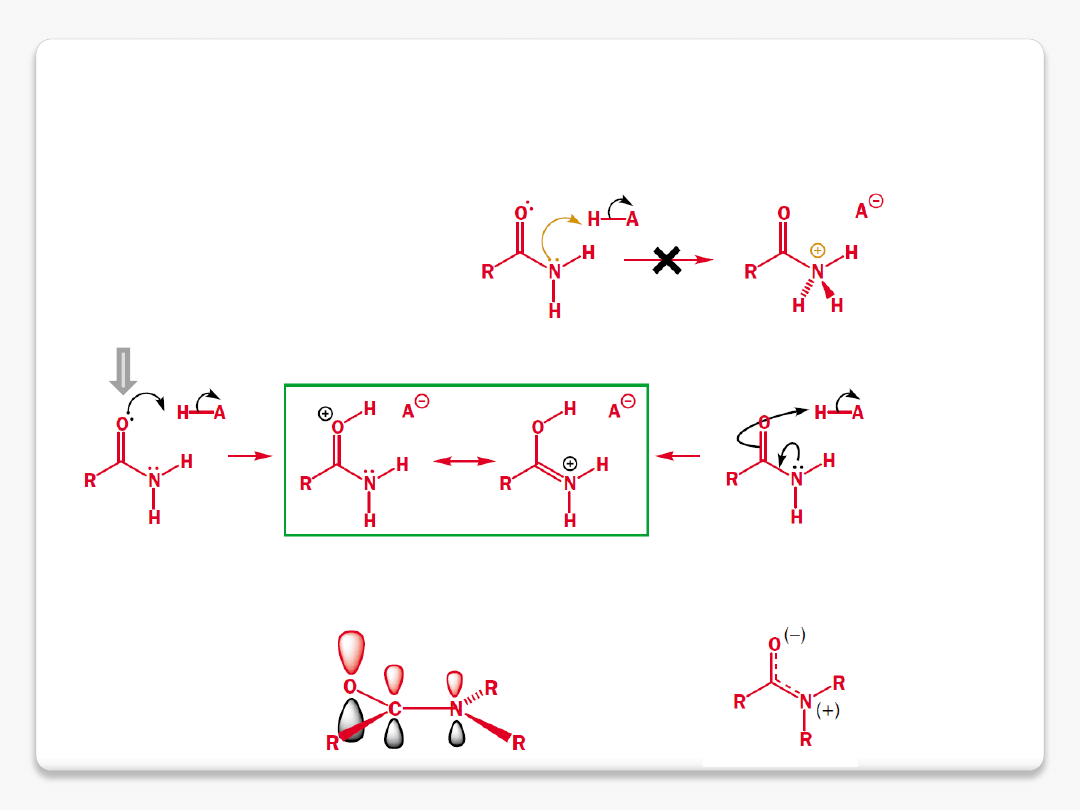
amidy – protonowanie na tlenie
protonowanie na atomie tlenu
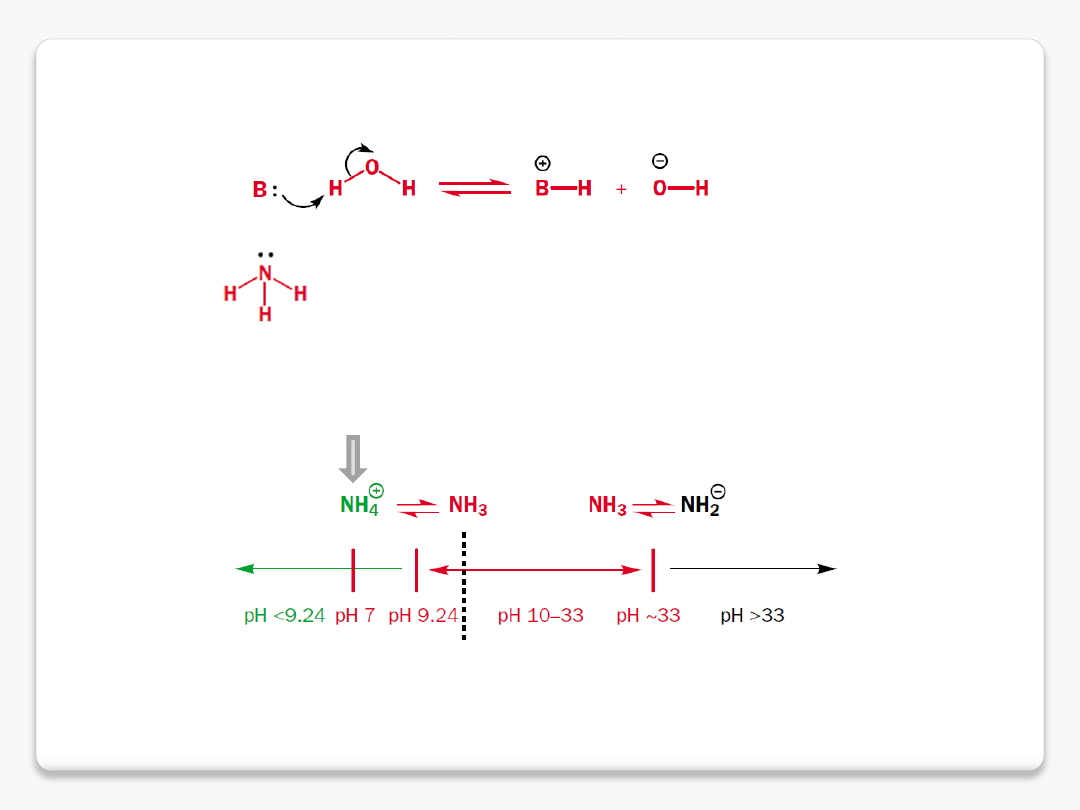
zasadowość
amoniak jest słabszą zasadą od jonu
wodorotlenowego
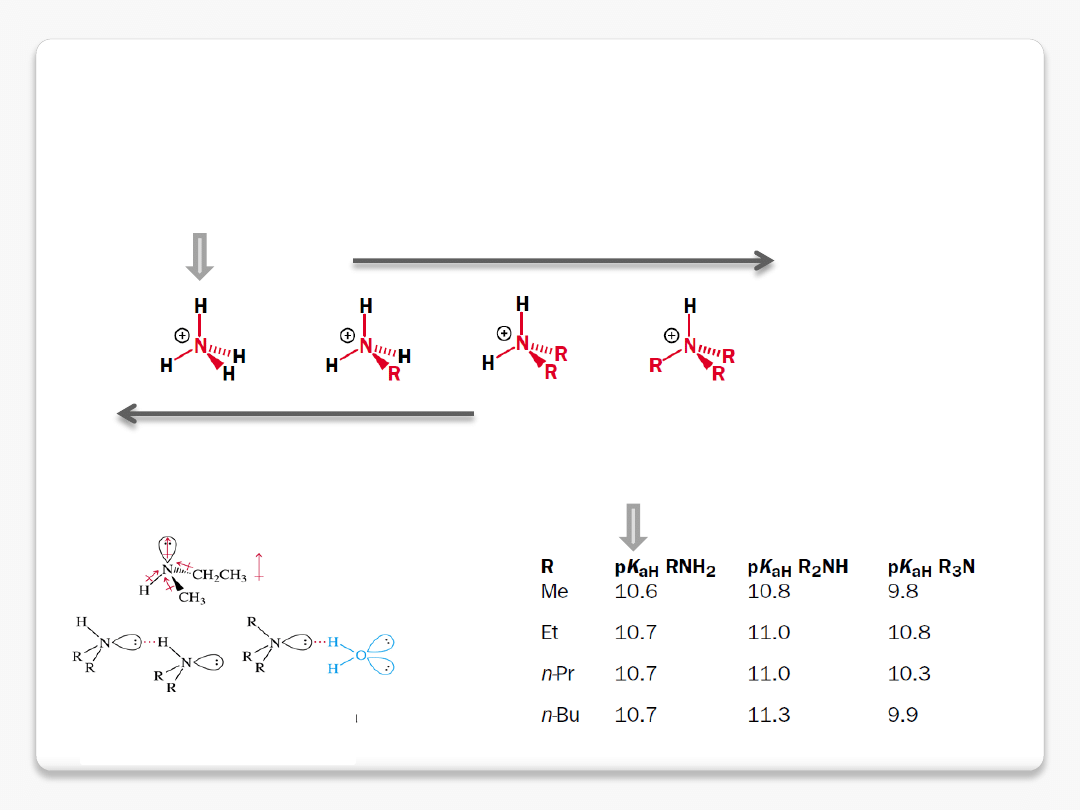
zasadowość amin – efekty zwiększające gęstość elektronową na azocie
używamy pK
aH
w znaczeniu pK
a
sprzężonego kwasu
większa stabilizacja ładunku dodatniego
przez grupy alkilowe
większa stabilizacja ładunku dodatniego
przez wiązania wodorowe z rozpuszczalnikiem
amoniak pK
aH
9.2
zasady silniejsze od amoniaku
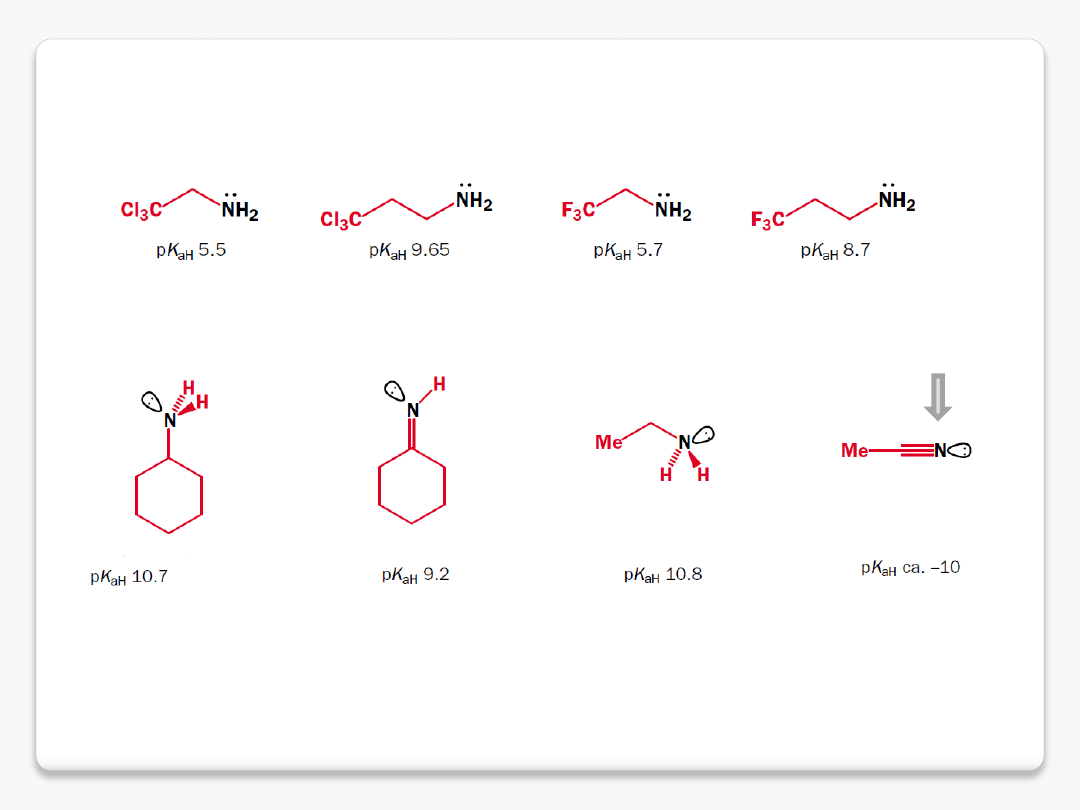
zasadowość amin – efekty zmniejszające gęstość elektronową na azocie
w im większym stopniu orbital ma charakter orbitalu s, tym bardziej utrzymuje
na sobie elektrony – wolna para trudniej dostępna
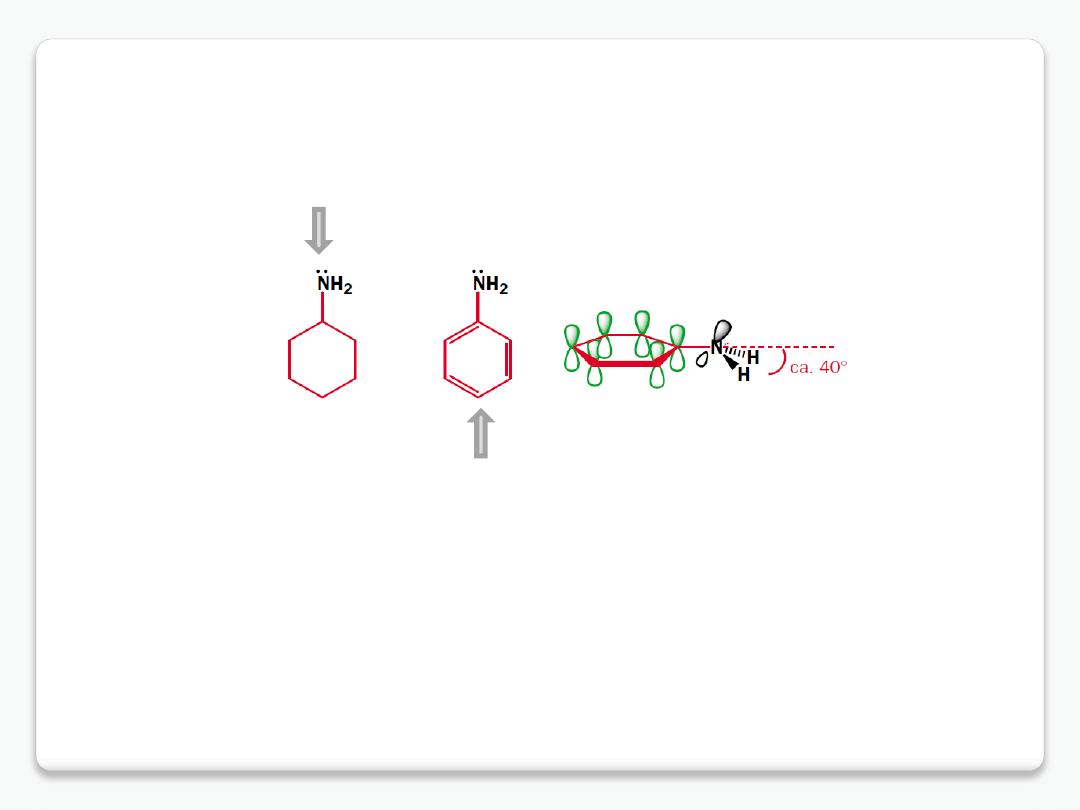
zasadowość amin – efekty zmniejszające gęstość elektronową na azocie
cykloheksyloamina pK
aH
10.7
anilina pK
aH
4.6
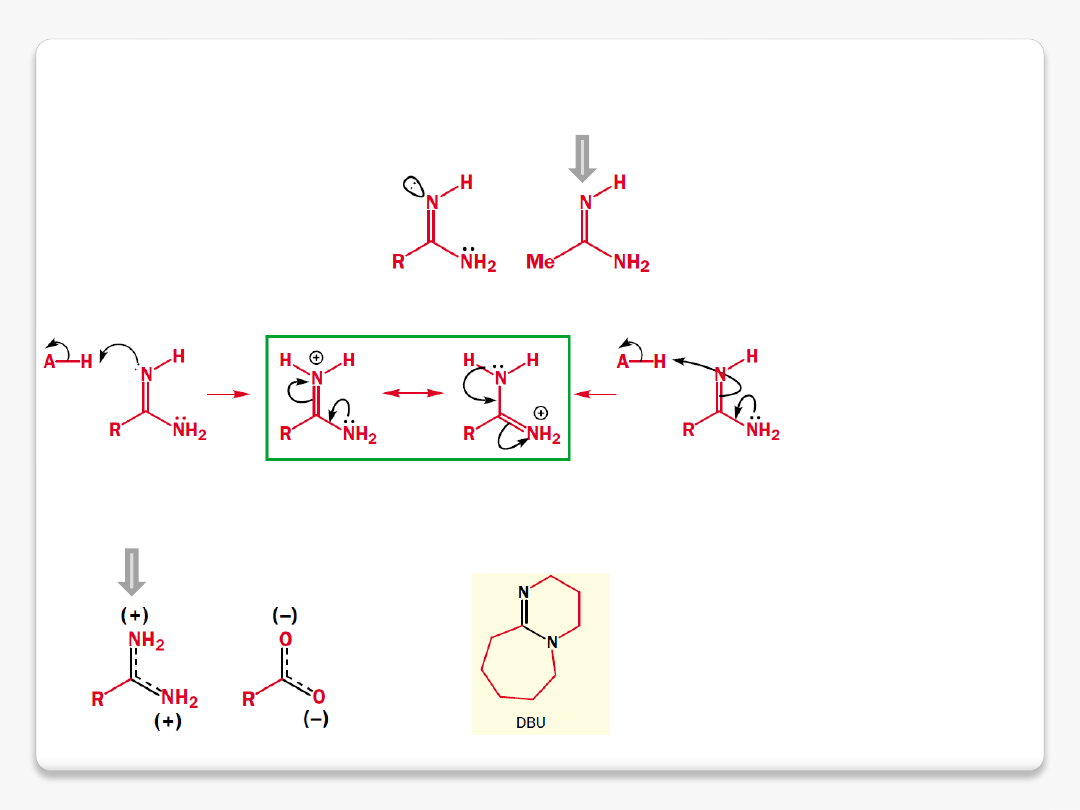
amidyny
amidyna pK
aH
12.4
kation amidyniowy
1,8-diazabicyklo[5.4.0]undec-7-ene
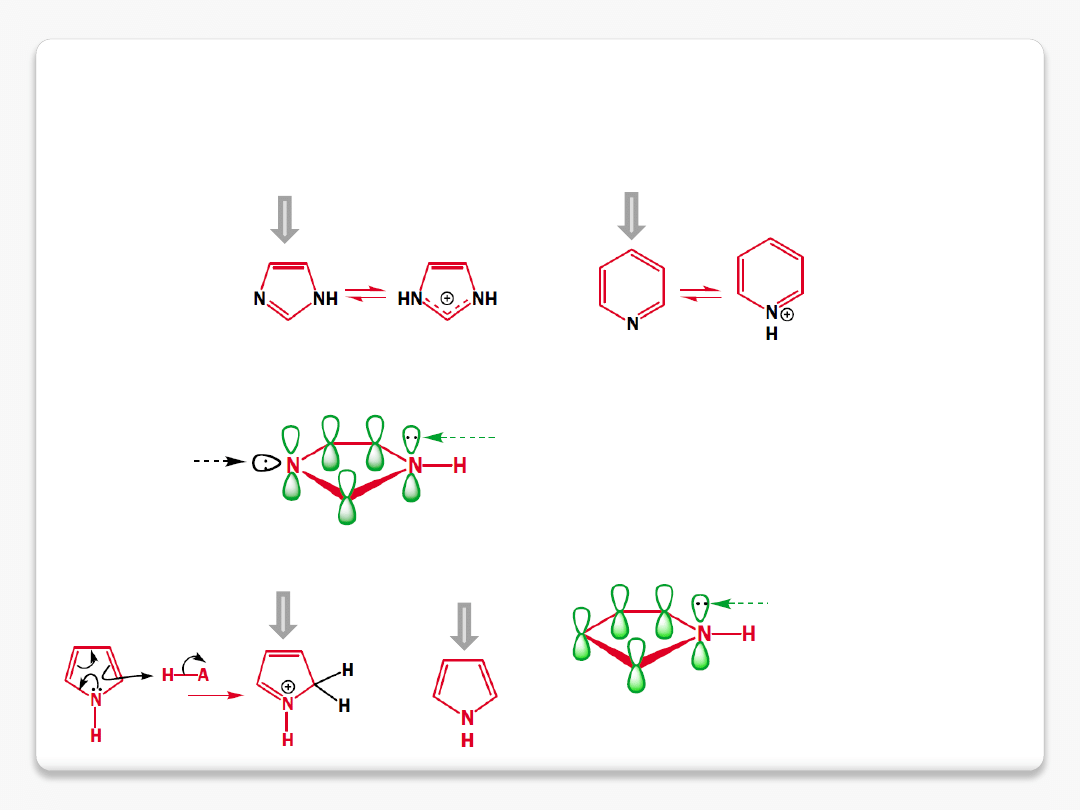
zasadowość amin
imidazol pK
aH
7.1
pirydyna pK
aH
5.2
uczestniczy w rezonansie
wolna para
pirol pK
aH
-4
uczestniczy w rezonansie
niearomatyczny kation
protonowanie nie zmienia charakteru aromatycznego imidazolu i pirydyny
Wyszukiwarka
Podobne podstrony:
Ch organiczna wykład 1d
Ch organiczna wykład 1g
Ch organiczna wykład 1e
Ch organiczna wykład 1d
Ch organiczna wykład 1g
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
dyd k2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd kzb, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd kza r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e1c, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd tech11, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd k3a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd e2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd k3b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd k1c r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
9 Ch organiczna WĘGLOWODANY
więcej podobnych podstron