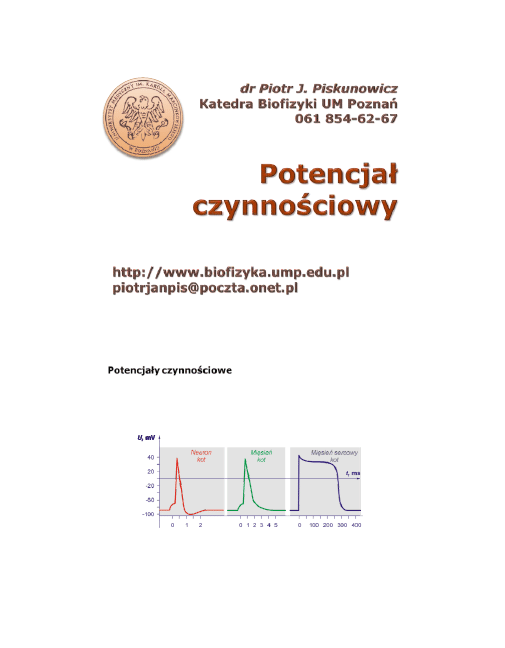
1
Potencjały czynnościowe
Komórki mięśniowe, nerwowe i receptorowe należą do klasy komórek
pobudliwych.
P
od wpływem różnych bodźców (chemicznych, elektry-
cznych, mechanicznych) może dojść w nich do takiego zaburzenia po-
tencjału błonowego, które doprowadzi do wyidukowania
potencjału
czynnościowego.
Typowe potencjały czynnościowe rejestrowane w różnych pobudli-
wych komórkach ssaków.
Czasowy przebieg zmian potencjału czyn-
nościowego zależy od rodzaju komórki i jej funkcji fizjologicznych.
2
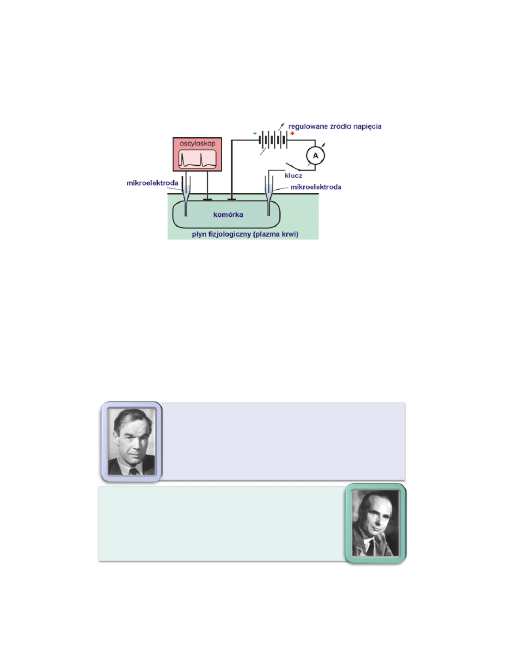
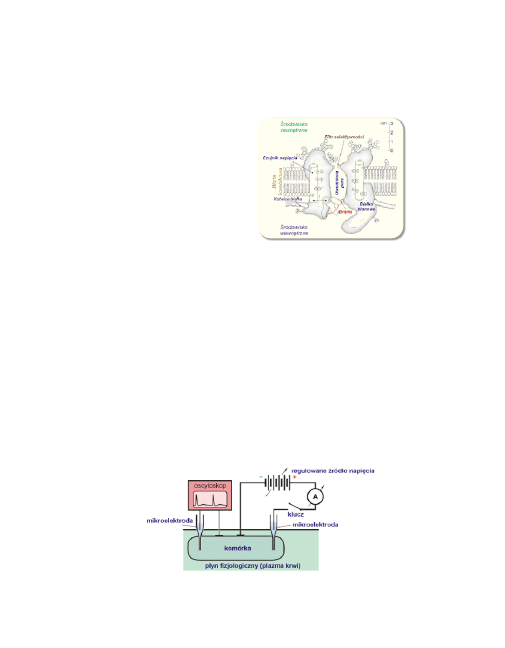
Do badania potencjałów czynnościowych można użyć układu pomiaro-
wego, takiego jak pokazany na poniższym rysunku. Do drażnienia ko-
mórki użyto bodźców elektrycznych, których amplitudę i czas trwania
można kontrolować.
Można wtedy rejestrować, przy pomocy oscyloskopu, zmiany wartości
potencjału błonowego w określonym miejscu błony, w zależności od u-
żytego bodźca. Pierwsze tego typu badania wykonano na gigantycz-
nych aksonach kałamarnicy (średnica 1 mm).
Sir Alan Lloyd
HODGKIN (1914−1998), fizjolog ang.; od 1952 profesor
uniwersytetu w Cambridge; czł. m.in. Tow. Król. w Londynie, Akademii
Przyrodników w Halle; badania gł. nad przewodzeniem impulsów w ukła-
dzie nerwowym; 1963 otrzymał Nagrodę Nobla (wspólnie z J.C. Ecclesem i
A.F. Huxleyem) za odkrycia dotyczące roli jonów sodowych w przewodni-
ctwie nerwowym.
Sir Andrew Fielding
HUXLEY (ur. 1917), fizjolog ang.; od 1960 prof. uniw.
w Londynie; czł. m.in. Tow. Król. w Londynie; badania nad chemizmem pro-
cesów pobudzenia i przewodnictwa nerwowego; 1963 otrzymał Nagrodę No-
bla (wspólnie z J.C. Ecclesem i A.L. Hodgkinem) za odkrycia dotyczące roli
jonów sodowych w przewodnictwie nerwowym.
Szczególnie duży wkład do uzyskania i wyjaśnienia wyników tego typu ba-
dań wnieśli:

3
N
atura
P
otencjału
C
zynnościowego
Potencjał czynnościowy, w komórkach pobudliwych, powstaje, gdy
de-
polaryzacja błony osiągnie próg pobudliwości
(około - 50 mV).
Przy takiej depolaryzacji potencjał błonowy staje się niestabilny. Stan
ten nazywa się
wzbudzeniem
błony, w neuronie trwa około 1 ms.
Czasowy kształt potencjału czynnościowego właściwy jest dla każdego
typu komórek nerwowych i mięśniowych. Jest on taki sam dla danego
typu komórek, stąd wzbudzenie przebiega zgodnie z prawem
„wszys-
tko albo nic”.
Rozpatrzmy powstawanie potencjałów w neuronach. Powstające w nich
potencjały czynnościowe umożliwiają przekazywanie, porównywanie i
analizę otrzymywanych przez nie informacji, umożliwiają regulację
funkcjami innych komórek.
Budowa komórki nerwowej - neuronu. Długość aksonu może dochodzić do 1 m
przy grubości od 1 do 6 µm.
Typowy przebieg czasowych zmian potencjału czynnościowego dla neuronów ilu-
struje poniższy rysunek, na którym zaznaczono też najważniejsze pojęcia zwią-
zane z potencjałem czynnościowym.
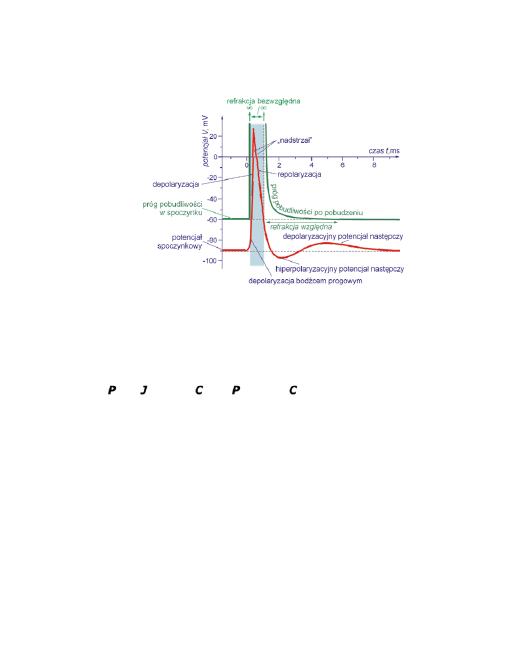
4
Kolejne fazy potencjału czynno-
ciowego neuronu.
Przyjrzyjmy się bliżej potencjałom czynnościowym generowanym ponadprogo-
wymi bodźcami elektrycznymi w neuronach człowieka.
P
rądy
J
onowe w
C
zasie
P
otencjału
C
zynnościowego
Przyczyną powstawania potencjału czynnościowego może być
jedynie
wzrost przewodności
κ
Na
błony dla jonów Na
+
, bowiem jedynie dla
tych jonów potencjał równowagowy jest dodatni (ε
Na
= +
60 mV).
Istotnie brak jonów Na
+
w płynie międzykomórkowym blokuje
powstanie potencjału czynnościowego nawet przy dużym stopniu
depolaryzacji błony.
Wzrost przewodności błony dla Na
+
musi być wynikiem depolary-
zacji błony do progu jej pobudliwości i jednocześnie stanowi me-
chanizm jej dalszej depolaryzacji.
Istotna jest także rola przewodności właściwej κ
K
dla jonów K
+
. Jeśli
obniżyć przewodność κ
K
błony
(np. tetraetyloamonem)
dla jonów K
+
, to
błona repolaryzuje się po wzbudzeniu znacznie wolniej.
Oznacza to, że
wzrost κ
K
, stanowi mechanizm repolaryzacji błony.

5
Ilościowe związki pomiędzy prądami jonowymi w czasie powstawania
potencjałów czynnościowych można badać
metodą kompensacji po-
tencjału,
zaproponowaną przez A.L. Hodgkina i A.F. Huxley'a.
Trzeba podkreślić, że liczba jonów przepływająca w czasie powstawa-
nia potencjału czynnościowego jest mała w porównaniu z ich całkowi-
tą liczbą w cytoplazmie i płynie międzykomórkowym.
Zmiana potencjału wnętrza komórki z -90 mV na +30 mV oznacza na-
pływ na 1 μm
2
powierzchni błony około 6300 jonów Na
+
, gdy w 1 μm
3
płynu międzykomórkowego jest ich około 108
10
6
a w cytoplazmie o-
koło 10
10
6
.
K
inetyka
P
rądów
J
onowych
Depolaryzacja błony w czasie jej wzbudzenia zmienia jej przewodność
dla jonów sodowych i potasowych, z kolei zmiana przewodności powo-
duje zmiany potencjału błony.
Ten złożony proces można wyjaśnić jedynie na drodze oceny zależno-
ści przewodności błony od aktualnego potencjału błonowego. Trzeba
zatem utrzymywać stałą wartość potencjału błonowego oraz mierzyć
jednocześnie prądy jonowe.
Stanowi to zasadę metody kompensacji potencjału (voltage clamp).
Odpowiedni układ pomiarowy ilustruje poniższy rysunek.
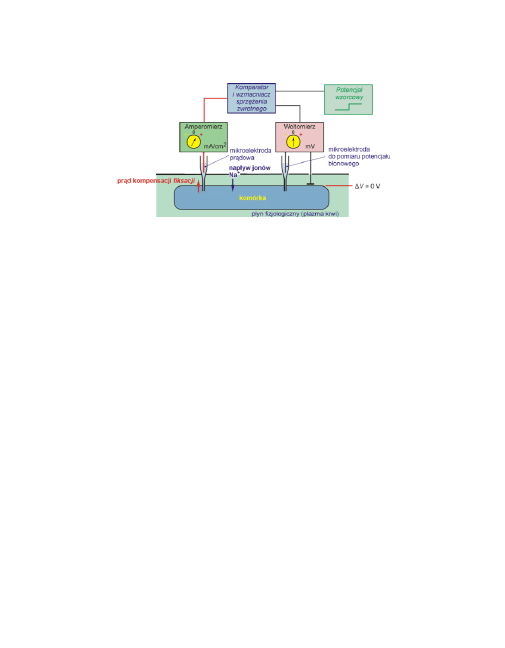
6
Układ kompensacyjny do pomiaru prądów jonowych w komórce zapro-
jektowany przez A.L. Hodgkina i A.F. Huxley'a. Badano gigantyczny ne-
uron kałamarnicy (Loligo) o średnicy aksonu około 1 mm. Układ porów-
nuje zadaną wartość potencjału (wzorcową) z tą aktualnie panującą
na błonie i dobiera taką wartość prąd przepływającego przez komórkę
(prądu kompensacji, fiksacji) aby potencjał błonowy był równy z wzor-
cowym.
W sytuacji na rysunku potencjał wzorcowy wynosił 0 mV, do komórki
napływa prąd Na
+
. Aby w wyniku jego napływu potencjał błonowy nie
uległ zmianie, trzeba w układzie sprzężenia zwrotnego wzbudzić prąd
równy co do wartości prądowi sodowemu, ale przeciwnie do niego
skierowany − prąd kompensacji, który stanowi „zwierciadlane odbicie
prądów” przepływających przez błonę przy zadanej wartości poten-
cjału błony.
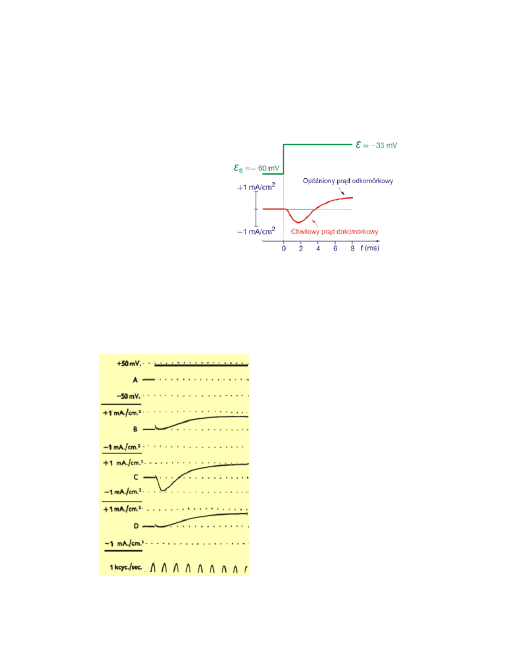
7
Wyniki doświadczenia
A.L.Hodgkina i A.F.Huxley'a, czyli prądy błono-
we przy różnych wartościach depolaryzacji błony ilustrują kolejne rysunki.
Podobne prądy rejestrowano także w neuronach kręgowców. Przyjmuje się je
także za typowe dla neuronów człowieka.
Na poniższym rysunku przedstawiono czasowe zmiany prądu kompensacji re-
jestrowane przy depolaryzacji błony do wartości ε=-33 mV. Potencjał spoczyn-
kowy neuronu kałamarnicy wynosi -60 mV.
W ciągu pierwszej milisekundy pojawia się ujemny prąd kompensacji, który z
upływem czasu zmienia się na dodatni i ustala po upływie około 8 ms ma po-
ziomie mniejszym od 1 mA/cm
2
.
Dodatnie prądy kompensacji związane są z
wypływem jonów z komórki, ujemne z ich napływem.
A.F. H
U X L E Y
The quantitative analysis of excitation and
conduction in nerve
Nobel Lecture, December 11, 1963
Prądy jonowe rejestrowane metodą kom-
pensacji potencjału o wartości 50 mV po-
nad potencjał spoczynkowy.
Rysunek B pokazuje prąd kompensacji,
gdy neuron umieszczono w wodzie mor-
skiej, gdzie 100% NaCl zastąpiono chlor-
kiem choliny.
C − neuron umieszczony w normalnej wo-
dzie morskiej.
D ponownie w roztworze takim, jak w B,
temperatura 8,5ºC.
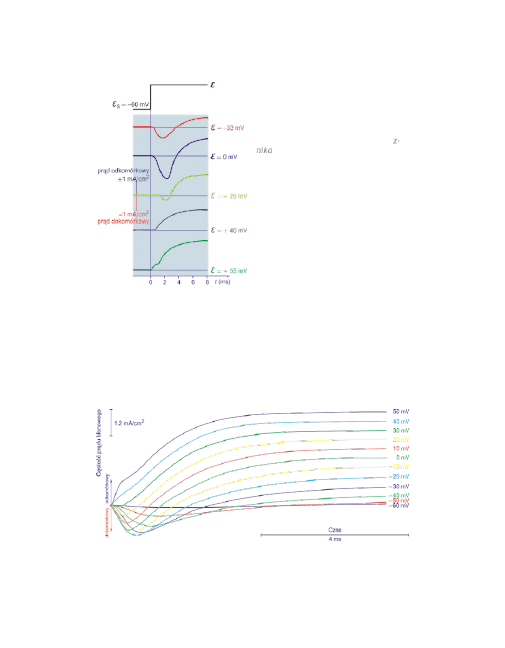
8
Wraz ze wzrostem stopnia depolaryza-
cji, obie składowe prądu (dodatnia i u-
jemna) zwiększają się, gdy depolaryza-
cję ustalić na poziomie 0 mV.
Początkowa ujemna składowa prądu z-
nika przy depolaryzacji do +40 mV.
Przy +55 mV występuje czysta składowa
dodatnia, ale z pewnym opóźnieniem
względem momentu ustalenia potencja-
łu.
Równowagowy potencjał jonów Na
+
dla
aksonu kałamarnicy wynosi +40 mV.
Dopóki potencjał depolaryzacji jest ni-
ższy od tej wartości prąd sodowy po-
winien wchodzić do komórki (co odpo-
wiada ujemnemu prądowi kompensa-
cji), a przy wyższych powinien wycho-
dzić (dodatni prąd kompensacji).
Ewolucję zmian udziału prądu dokomórkowego i odkomórkowego, w zależności od
depolaryzacji, doskonale ilustruje poniższy rysunek.
Potencjał spoczynkowy wynosił tutaj -70 mV, a równowagowy potencjał dla jo-
nów Na
+
wynosi +30 mV.
Dopóki potencjał depolaryzacji jest niższy od
+
30 mV
prąd sodowy wpływa do ko-
mórki (co odpowiada początkowemu ujemnemu prądowi kompensacji).

9
Sugeruje to, że początkowy prąd kompensacji związany jest z prądem
jonów Na
+
napływających do komórki. Potwierdzają to także inne fak-
ty: jeśli w płynie międzykomórkowym zastąpić jony Na
+
większymi jo-
nami (cholina) to znika początkowy ujemny prąd kompensacji.
Zatem ponadprogowa spontaniczna depolaryzacja związana
jest z napływającym do komórki prądem jonów sodowych.
Natomiast po prądzie sodowym pojawia się prąd jonów K
+
.
Prąd ten w czystej składowej występuje przy depolaryzacji +40 mV,
gdyż wtedy prąd sodowy znika. Powstający w tych warunkach prąd kom-
pensacji pojawia się z pewnym opóźnieniem i w ciągu 8 ms osiąga ma-
ksymalną stałą wartość w czasie. Jeśli wykorzystać jako płyn między-
komórkowy roztwory fizjologiczne pozbawione jonów Na
+
, to przy każ-
dym poziomie depolaryzacji obserwuje się wyłącznie prąd K
+
.
Doświadczenia takie dowodzą, że:
prąd K
+
przy każdym poziomie depolaryzacji pojawia się z opóź-
nieniem czasowym i osiąga maksimum po czasie około 5÷10 ms,
maksymalna wartość prądu K
+
rośnie wraz ze wzrostem stopnia
depolaryzacji,
prąd K
+
po osiągnięciu maksymalnej wartości nie zmienia się, gdy
utrzymywać stałą wartość depolaryzacji.
Prądy Na
+
i K
+
. Przewodność błony
Całkowity
J
T
prąd kompensacji stanowi sumę:
J
T
=
J
Na
+
J
K
prądu
J
Na
sodowego i
J
K
potasowego.
A.L.Hodgkin i A.F.Huxley zauważyli, że można oddzielić prąd potaso-
wy, gdy komórkę umieścić w roztworze pozbawionym jonów Na
+
i zba-
dać ponownie w tych warunkach prąd kompensacji, oczywiście pono-
wnie przy tym samym stopniu depolaryzacji błony.
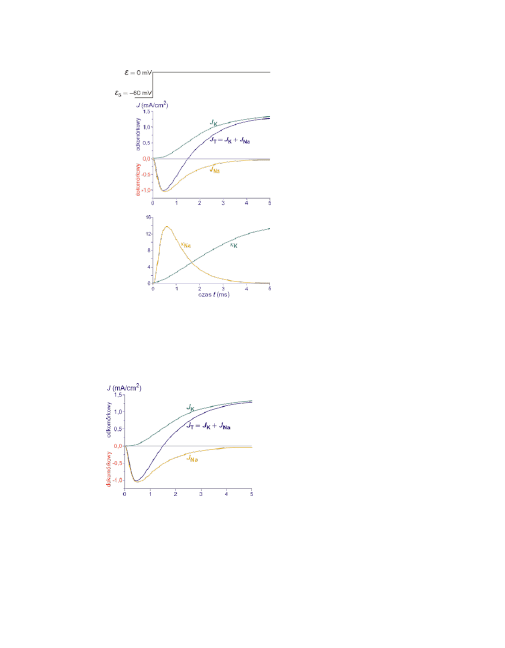
10
Depolaryzacja do 0 mV i po-
miar całkowitego J
T
prądu jo-
nowego.
Przy takiej samej depolaryza-
cji pomiar prądu J
K
potasowe-
go. Neuron w roztworze bez
sodu lub kanały sodowe zablo-
kowane.
Można teraz obliczyć wartości
prądu sodowego J
Na
.
Na podstawie wartości gęsto-
ści prądu i napięć można obli-
czyć chwilową przewodność
elektryczną błony dla jonów
sodowych κ
Na
i potasowych κ
K
w różnych chwilach po pobu-
dzeniu neuronu.
Z kolei prąd potasowy pojawia się z opóźnieniem i wolno rośnie do mak-
symalnej wartości, ustalając się na stałym poziomie. W tym samym czasie
prąd sodowy już praktycznie zniknął.
Jak widać prąd sodowy gwałtownie
narasta, osiąga maksimum po czasie
około 0,5 ms i równie gwałtownie
znika.
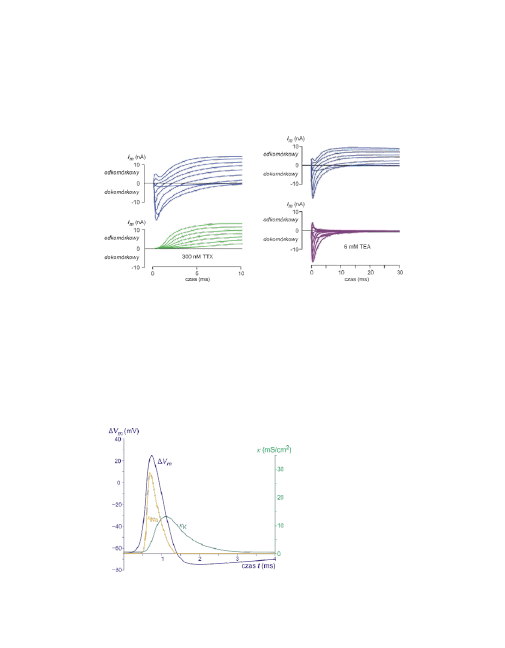
11
Pomiar prądu sodowego i potasowego
(rysunek górny) oraz selektywny po-
miar prądu potasowego
po zabloko-
waniu kanałów sodowych tetrodoto-
xinem (TTX).
Pomiar prądu sodowego i potasowego
oraz selektywny pomiar prądu sodo-
wego po
zablokowaniu kanałów pota-
sowych chlorkiem czteroetyloamo-
niowym (tetraethylammonium TEA).
Wartości przewodności właściwej κ
Na
i κ
K
dla jonów sodu i potasu zależą od
wartości depolaryzacji błony i czasu po jej depolaryzacji do ustalonej warto-
ści.
κ
Na
i κ
K
można opisać układem równań, które uwzględniają ich zależność od
potencjału błonowego i czasu po zmianie potencjału. Przy pomocy tego ukła-
du równań można zrekonstruować czasowe zmiany potencjału czynnościowe-
go po pobudzeniu ponadprogowym. Taką rekonstrukcję ilustruje rysunek.
Przewodność błony w czasie po-
tencjału czynnościowego w ak-
sonie kałamarnicy.
Wartości przewodności obliczo-
no z doświadczenia z kompen-
sacją potencjału.
Na podstawie chwilowych war-
tości przewodności obliczono
chwilowe wartości potencjału
czynnościowego.
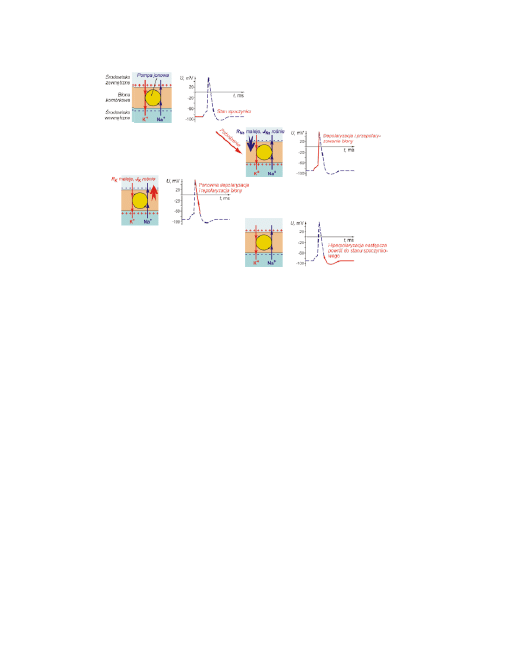
12
Schemat zmian potencjału błonowego oraz zmian przewodności w czasie jej
pobudzenia bodźcem ponadprogowym.
Inaktywacja układu Na
+
W aksonie kałamarnicy κ
Na
zaczyna maleć po około 0,5 ms,
w komórkach nerwowych kręgowców (przy wyższej temperaturze)
spadek ten może zaczynać się nawet po czasie krótszym niż 0,1 ms.
Szybki spadek κ
Na
nazywa się inaktywacją układu sodowego
.
Szybkość
i stopień inaktywacji zależy od potencjału depolaryzacji.
Zależność tę można ocenić następująco:
Utrzymuje się potencjał błony
ε
w czasie kilku ms na ustalonym
poziomie, tak długo dopóki nie zostanie osiągnięta inaktywacja
Na
+
.
Następnie mierzy się prąd sodowy wywołany zawsze taką samą
depolaryzacją.
Wyniki takiego doświadczenia ilustruje poniższy rysunek.
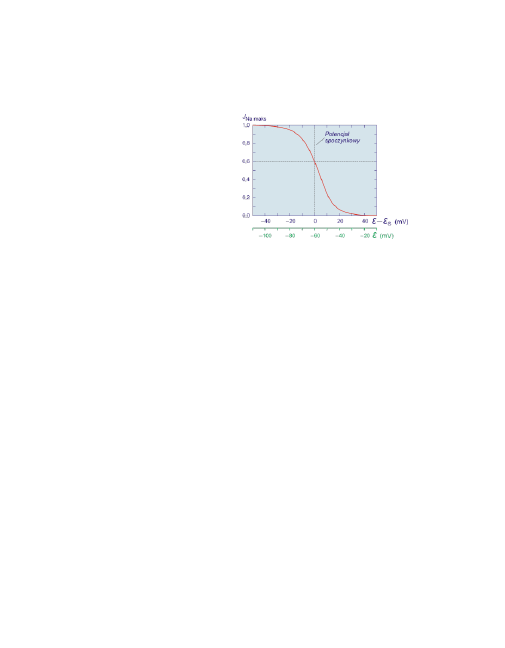
13
Widać, że maksymalny prąd sodowy
zyskuje się przy depolaryzacji bar-
dziej ujemnej niż potencjał spoczy-
nkowy. Przy depolaryzacji bardziej
dodatniej niż potencjał spoczynko-
wy prąd sodowy jest w dużym sto-
pniu inaktywowany.
Zależność stopnia inaktywacji układu Na
+
od wartości potencjału błonowego.
A.L.Hodgkin i A.F.Huxley ustalali potencjał błonowy na stałym poziomie, po ustaleniu
się prądu sodowego depolaryzowali błonę do -16 mV i obserwowali zmiany prądu so-
dowego. W stanie spoczynku układ Na
+
jest w 60 % aktywny.
Przy wyjściowej depolaryzacji o 20 do 30 mV wyższej niż potencjał spoczynkowy pra-
wie w ogóle nie można wywołać prądu sodowego. Dla takich wartości potencjału uk-
ład Na
+
jest całkowicie nieaktywny, niezależnie od stopnia depolaryzacji. Podobne
zależności stopnia inaktywacji układu Na
+
obserwowano także w komórkach mięśnio-
wych i nerwowych ssaków.
Czynniki wpływające na inaktywację
Zależny od potencjału stopień inaktywacji układu Na
+
wpływa na pobudli-
wość komórki. Jeśli potencjał spoczynkowy komórki ssaków stanie się bar-
dziej dodatni niż -50 mV (przy niedotlenieniu lub pod działaniem rekla-
ksatorów typu sukcynilocholiny) układ Na
+
jest nieaktywny − komórki są
niepobudliwe.
Wzrost stężenia Ca
2+
przesuwa zależność stopnia inaktywacji układu sodo-
wego od potencjału błonowego w prawo, a obniżenie stężenia tych jonów
w lewo. Wzrost stężenia jonów wapnia ułatwia zatem aktywację układu
Na
+
, ale jednocześnie przesuwa próg pobudliwości w górę. Stąd wzrost
stężenia jonów wapnia powoduje, że komórka staje się mniej pobudliwa,
a obniżenie powoduje wzrost stopnia jej pobudliwości.
Dlatego deficyt Ca
2+
prowadzi do mimowolnych skurczy mięśni. Podobne
efekty jak zmiana koncentracji wapnia wywołują znieczulenia miejscowe
(nowokaina). Preparaty antyarytmiczne podobnie oddziałują na mięsień
sercowy. Wszystkie te substancje obniżają pobudliwość komórek w wyniku
przesunięcia inaktywacji sodu lub potencjału progowego.
Trzeba podkreślić, że układ K
+
inaktywacji nie podlega. Wzrost przewod-
ności dla jonów potasowych odpowiada za repolaryzację.
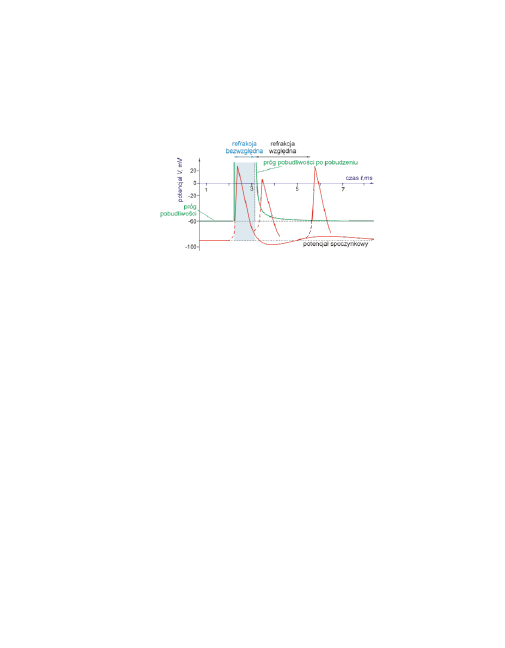
14
Okresy refrakcji
Ważnym następstwem inaktywacji układu Na
+
jest
refrakcja
błony.
Ilustruje to poniższy rysunek. W neuronie wywołano potencjał czynno-
ściowy, następnie w różnych odstępach czasu działano kolejnym bodź-
cem.
Czerwona przerywana linia zaznaczona na rysunku oznacza depolaryza-
cję wywołaną działaniem bodźca.
Jeśli depolaryzować błonę natychmiast po powstaniu potencjału czyn-
nościowego, to wzbudzenie nie powstaje przy żadnej wartości depola-
ryzacji. Jest to stan pełnej
niepobudliwości − refrakcja bezwzględna
RB,
która trwa w czasie depolaryzacji, przepolaryzowania i w ciągu
około ⅓ czasu repolaryzacji, w neuronie około 1 ms.
Po czym następuje
refrakcja względna RW
, gdy do pobudzenia wyma-
gana jest znacznie wyższa depolaryzacja niż w warunkach normal-
nych. Potencjał czynnościowy wywołany w tym okresie ma niższą am-
plitudę niż normalnie. Powrót do normy oznacza zakończenie okresu
refrakcji względnej. Zjawiska te związane są z inaktywacją układu
Na
+
.
Okres refrakcji bezwzględnej ogranicza częstotliwość generacji po-
tencjału czynnościowego.
Gdy RB jest rzędu 2 ms to maksymalna częstotliwość pobudzeń wynosi
500 Hz. Maksymalne częstotliwości pobudzeń w neuronach ssaków do-
chodzą do 1000 Hz.

15
Struktura błony i wzbudzenie
Możliwość wzbudzenia komórki wynika z aktywacji układu Na
+
, jest
skutkiem szybkiego wzrostu przepuszczalności błony dla jonów sodo-
wych. Jakie są molekularne mechanizmy takiego zjawiska? Pewną
wskazówką było
odkrycie prądu przemieszczenia
w błonie tuż przed
rozpoczęciem potencjału czynnościowego. Wskazuje to na istnienie w
błonie kanałów aktywowanych elektrycznie.
Ogólna klasyfikacja i własności kanałów
jonowych
Kanałami jonowymi nazywamy białka integralne posiadające zdolność
do kontrolowanego przepuszczania jonów. Jedną z podstawowych
cech budowy wszystkich kanałów jonowych jest występowanie w nich
tzw. pory wodnej − hydrofilowej przestrzeni wewnątrz białka, przez
którą jony mogą przenikać przez błonę komórkową. Cechą charaktery-
styczną kanałów jonowych jest to, że pora wodna ulega otwarciu lub
zamknięciu w zależności od czynników zewnętrznych.
Ze względu na rodzaj czynnika otwierającego (aktywującego) kanały
jonowe dzielimy na trzy zasadnicze grupy:
kanały zależne od napięcia,
kanały zależne od ligandu,
kanały aktywowane naprężeniem mechanicznym.
Bardzo istotną cechą kanałów jest ich
selektywność
, czyli zdolność
do przepuszczania ściśle określonych typów jonów. Mówimy więc o ka-
nałach kationowych lub anionowych, a gdy kanały są jeszcze bardziej
„wyspecjalizowane” to określamy je jako sodowe, potasowe itd.
Trzeba tu jednak zaznaczyć, że określenie: np. kanał sodowy oznacza
jedynie, iż kanał ten najlepiej przepuszcza jony sodu. Oprócz nich,
choć znacznie gorzej, mogą przez ten kanał przechodzić także inne
kationy.

16
Niezależnie od rodzaju kanału jego otwieranie się jest pro-
cesem typu "wszystko albo nic".
Oznacza to, że kanał albo jest zamknięty i nie przewodzi jonów, albo
jest otwarty i wówczas jego przepuszczalność
nie zależy od wielkości
czynnika otwierającego
. Procesy zmiany stanu kanału jonowego są
jednak procesami przypadkowymi (stochastycznymi). Tak więc na
przykład zaistnienie czynnika powodującego otwarcie kanału wpływa
jedynie na prawdopodobieństwo tego, że kanał będzie znajdował się w
stanie otwartym. Konsekwencją takiego zachowania się pojedynczych
kanałów jest to, że
wielkość czynnika otwierającego wpływa na ilość
kanałów jonowych w błonie znajdujących się w stanie otwartym.
Kanały zależne od napięcia
Kanały zależne od napięcia regulowane są przez potencjał błonowy.
Prawdopodobieństwo otwarcia tych kanałów wzrasta wraz ze wzrostem poten-
cjału błonowego − mówimy, że są to kanały aktywowane przez depolaryzację.
Istnieją jednak również kanały aktywowane przez hiperpolaryzację błony.
Wrażliwość kanałów na potencjał błonowy wynika z obecności w strukturze
białka kanałowego naładowanego elektrycznie fragmentu (nazywanego
czujni-
kiem potencjału
) reagującego na zmiany pola elektrycznego w błonie. Uważa
się, że ruch tego czujnika powoduje zmianę konformacji białka kanałowego
prowadzącą do przemieszczenia tzw.
bramki aktywacyjnej
, otwierającej porę
wodną.
Innym istotnym elementem kanału zależnego od napięcia jest tzw.
bramka in-
aktywacyjna
. Obecność tej bramki powoduje, że kanał po otwarciu bramki ak-
tywacyjnej po pewnym czasie przestaje przewodzić jony - niezależnie od te-
go, że napięcie na błonie sprzyja jego otwarciu. Mówimy wówczas, że kanał
znajduje się w stanie inaktywacji. Ponowne otwarcie bramki inaktywacyjnej
jest możliwe dopiero, gdy potencjał błonowy powróci do wartości spoczynko-
wej.

17
Aniono − bądź kationo −
selektywność kanałów
(nie tylko zależnych od na-
pięcia) związana jest z istnieniem
filtra selektywności
.
Filtrem tym są do-
datnio (kanały anionoselektywne) lub ujemnie (kanały kationoselektywne) na-
ładowane fragmenty molekuły białka kanałowego. Dzięki elektrostatycznemu
odpychaniu przez filtr „niewłaściwe” jony nie mogą wchodzić do wnętrza ka-
nału. Sądzi się obecnie, że budowa wnętrza kanału (czyli „ściany” pory wod-
nej) ma decydujące znaczenie dla zdolności kanału do przepuszczania specyfi-
cznych jonów (sodowych, potasowych itp.).
Zależne od napięcia kanały sodowe i potasowe są odpowiedzialne za zmiany
przepuszczalności błony wielu typów komórek pobudliwych w trakcie poten-
cjału czynnościowego. Jeśli bodziec pobudzający błonę ma wielkość ponad-
progową to powoduje on otwarcie odpowiednio dużej ilości kanałów sodowych
i gwałtowny wzrost przewodnictwa błony dla jonów sodowych. Kanały sodowe
po krótkim czasie ulegają inaktywacji i przewodnictwo błony dla sodu szybko
maleje. Jednocześnie z kanałami sodowymi otwieraniu ulegają kanały potaso-
we – proces ten jest jednak wolniejszy i dlatego błona później osiąga maksy-
malną wartość przewodnictwa dla jonów potasu.
Kanały zależne od ligandu
Kanały zależne od ligandu (nazywane również kanałami
aktywowanymi chemi-
cznie
) otwierają się, gdy cząsteczka (lub większa ich ilość − w zależności od
typu kanału) ligandu zostaje związana w specyficznym dla niej miejscu wiążą-
cym w molekule białka kanału. Ponieważ wiązanie ligandu jest odwracalne,
więc po pewnym czasie po związaniu z białkiem ligand odłącza się od jego
cząsteczki i kanał ulega zamknięciu. Jednakże jeśli stężenie ligandu jest wy-
starczające, to możliwe jest przyłączenie kolejnej jego cząsteczki i ponowne
otwarcie kanału.

18
W przypadku tych kanałów istnieje mechanizm zbliżony do inaktywacji kana-
łów zależnych od napięcia − nazywany jest on
odczuleniem
. Polega ono na
okresowej utracie wrażliwości na obecność ligandu przez kanały poddane
przedłużającej się obecności wysokich stężeń ligandu. Odczulenie ustępuje,
gdy stężenie ligandu ulegnie znacznemu obniżeniu. Kanały zależne od ligandu
są klasyfikowane w zależno-ści od rodzaju cząsteczki aktywującej je. Mówimy
zatem o kanałach takich, jak receptory acetylocholiny, kwasu gammaamino-
masłowego (GABA), dopaminy i wielu innych. Podobnie, jak kanały zależne od
napięcia są one również selektywne względem różnych rodzajów jonów.
Różnorodność kanałów aktywowanych chemicznie pozwala na wykorzystywa-
nie ich do regulowania ogromnej ilości procesów zachodzących w żywych
komórkach. Biorą one udział między innymi
w transmisji synaptycznej i jej
modulacji, w procesie fotorecepcji, regulacji procesów fosforylacji białek itd.
Kanały aktywowane naprężeniem mechanicznym
Kanały aktywowane naprężeniem mechanicznym (mechanoreceptory) ulegają
otwarciu w odpowiedzi na pojawienie się w błonie sił (naprężeń) odkształcają-
cych ją. Ta ich właściwość powoduje, że są one wykorzystywane w komórkach
dokonujących zamiany sygnałów mechanicznych na elektryczne. Typowym
przykładem są tu komórki rzęsate znajdujące się w błonie podstawnej w na-
rządzie Cortiego, przetwarzające dźwięki na impulsy elektryczne. Mechano-
receptory są najmniej poznaną grupą kanałów jonowych.
19
Badania wskazały, że na powierzchni 1 μm
2
błony neuronów ist-
nieje około
50 kanałów sodowych o średnicy około 30 nm i średnio oddalo-
nych od siebie o 140 nm. Możliwą strukturę molekularną takiego kanału ilustruje
rysunek (Hille, 1992).
Przez te kanały mogą płynąć jony Na
+
(bar-
dzo słabo Ca
+
2
i K
+
, aniony w ogóle nie pły-
ną przez te kanały). Mechanizm aktywacji
kanału związany jest ze zmianą natężenia
pola elektrycznego w błonie. Kanał otwiera
się na krótki czas (1 ms) a następnie ulega
inaktywacji.
Podobnie można wyobrazić sobie działa-nie kanałów potasowych. Gęstość rozłożenia
kanałów potasowych jest mniejsza niż sodowych. Kanały te także posiadają mechani-
zm bramy zależny od potencjału na błonie.
Nie ulegają jednak inaktywacji.
Prądy jonowe w czasie potencjałów następczych
Często po repolaryzacji w komórce obserwuje się
hiperpolaryzacyjny poten-
cjał następczy
(neurony, komórki mięśnia sercowego). Zachodzi to wtedy, gdy
kanał potasowy po osiągnięciu przez błonę potencjału spoczynkowego nie zo-
stanie zamknięty. Potencjał hiperpolaryzacyjny zanika wraz z ustaniem działa-
nia kanału potasowego.
Bodziec a próg
Przy pomocy układu pokazanego na rysunku można badać relacje pomiędzy
natężeniem bodźca, czasem jego trwania i osiągnięciem progowej depolary-
zacji.
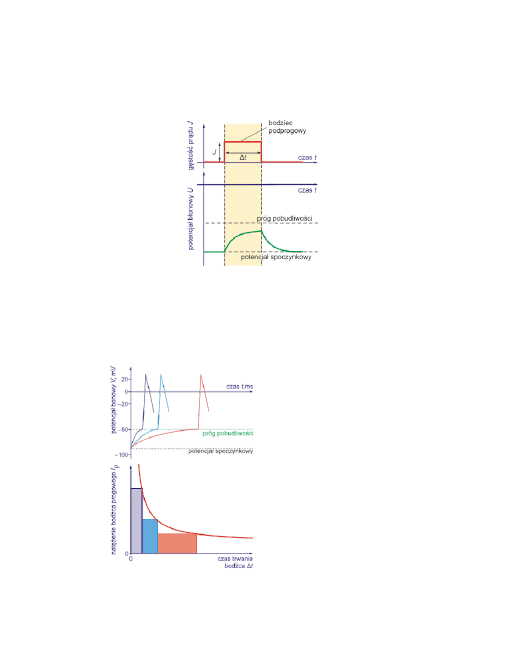
20
Z uwagi na
pojemność elektryczną błony komórkowej zmiany potencjału
na błonie wywołane
„prostokątnym” bodźcem mają kształt wykładniczy, tak
jak to pokazuje rysunek.
Podprogowy bodziec depolaryzujący i zmiany potencjału błonowego w komór-
ce pobudliwej.
Poszukiwanie minimalnego natężenia
bodźca, wywołującego powstanie po-
tencjału czynnościowego, przy okre-
ślonym czasie Δt trwania bodźca, u-
możliwia określenie wartości
pro-
gowego natężenia bodźca
J
p
.
Próg dla dłuższych bodźców jest niższy
niż dla krótszych. Rysunek ilustruje
zależność progowego natężenia bodź-
ca J
p
od czasu jego trwania.
21
Δ
P
R CH
J
R
t
Zależności
progowego natężenia bodźca
J
p
od czasu jego trwania Δt wy-
raża wzór:
gdzie:
R
– reobaza,
CH – chronaksja.
Poniższy rysunek ilustruje zależność progowego natężenia bodźca J
p
od czasu
jego trwania i wyjaśnia pojęcia chronaksji i reobazy.
Reobaza
oznacza natężenie bodź-
ca progowego o nieskończenie dłu-
gim czasie jego trwania.
Chronaksja
oznacza czas trwania
bodźca progowego, którego natę-
żenie jest równe dwukrotnej war-
tości reobazy.
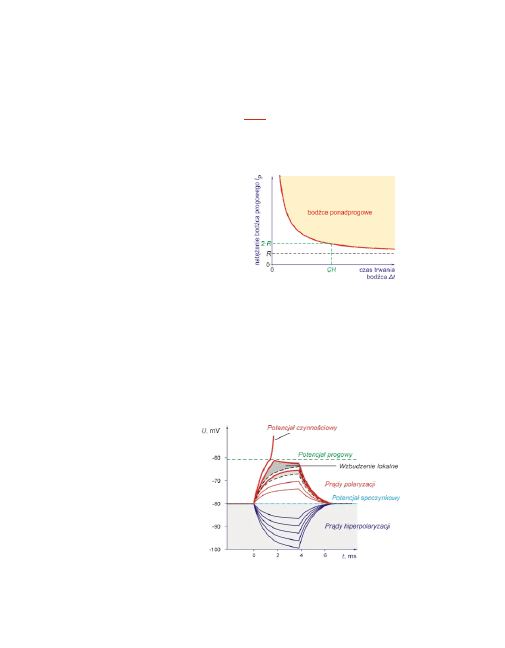
Bodźce okołoprogowe
Działanie kanałów sodowych nie rozpoczyna się dokładnie przy progowej depo-
laryzacji błony. Inny jest także przebieg zmian potencjału błonowego pod wpły-
wem depolaryzujących i hiperpolaryzujących bodźców o tym samym natężeniu.
Ilustruje to poniższy rysunek.
Obszar lokalnego wzbudze-
nia oznacza aktywację ka-
nałów sodowych, ale bar-
dzo ograniczoną. Jednak
nawet mały dodatkowy bo-
dziec może w takiej chwili
doprowadzić do powstania
potencjału czynnościowe-
go
22
Zmiany progu pobudliwości. Akomodacja
Dotychczas próg pobudliwości (minimalny poziom depolaryzacji) traktowaliśmy
jako wielkość stałą (poza zmianami po pobudzeniu komórki). Wiemy, że szereg
czynników może zmieniać stopień aktywacji kanałów sodowych oraz zmieniać
progowy potencjał depolaryzacji. Wśród tych czynników bardzo ważny jest
wyjściowy potencjał, przy którym działamy na komórkę bodźcem.
Długotrwała podprogowa depolary-
zacja inaktywuje układ Na
+
, a hi-
perpolaryzacja ułatwia jego akty-
wację.
Wynika stąd w szczególności, że przy
względnie wolnej depolaryzacji błony
od potencjału spoczynkowego układ
kanałów sodowych będzie − w dużej
mierze lub całkowicie − nieaktywny
zanim potencjał na błonie osiągnie
próg pobudliwości. Taka długotrwała
depolaryzacja prowdzi do
akomo-
dacji.
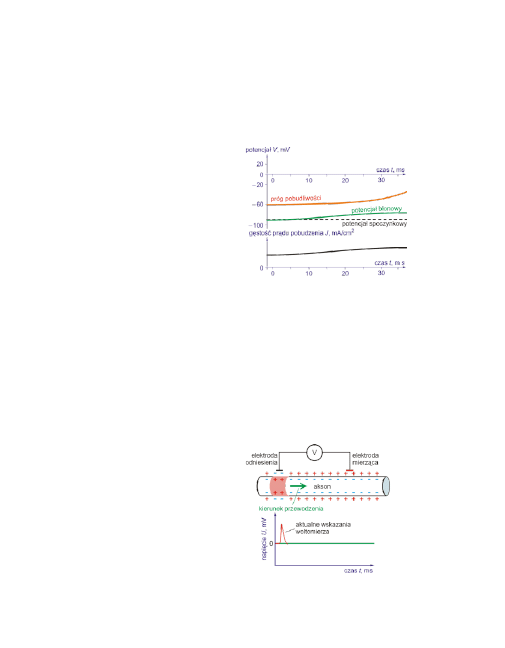
Rozchodzenie się potencjału czynnościowego
Potencjał czynnościowy
rozprzestrzenia się od wzgórka aksonu w kierunku drze-
wka końcowego.
Po pobudzeniu neuronu w określonym miejscu powstaje poten-
cjał czynnościowy, który można także rejestrować w dużych odległościach od
tego miejsca (np. w odległości 1 m).
Na całej długości aksonu posiada on tę samą amplitudę, ale pojawia się z pew-
nym opóźnieniem czasowym. Pomiar szybkości rozchodzenia się potencjału czy-
nnościowego można zrealizować w następujący sposób.
Potencjał czynnościowy rejestrowa-
ny zewnętrznymi elektrodami.
Dolny rysunek ilustruje zmiany po-
tencjału błony mierzone przy pomo-
cy elektrod rozmieszczonych jak na
rysunku górnym.

23
Prędkości rozchodzenia się potencjału czynnościowego zmieniają się od 100 m/s
(w aferentnych neuronach wrzecion mięśniowych, włóknach nerwowych mięśni
szkieletowych − duże średnice 13 μm, osłonki mielinowe) do 1 m/s (w aferen-
tnych neuronach skórnych, małe średnice 1 μm, brak osłonki mielinowej).
Jednokierunkowe przewodzenie potencjału czynnościowego wzdłuż włókna tłu-
maczy się powstawaniem we włóknie lokalnych prądów
, prowadzących do depo-
laryzacji włókna przed i za miejscem, do którego dotarł potencjał czynnościowy.
W obszarze „za” neuron jest w fazie refrakcji bezwzględnej, akty-
wne są kanały potasowe, ale nie są aktywne kanały sodowe. W ob-
szarze „przed” aktywizowane są kanały sodowe i powstaje poten-
cjał czynnościowy.
Czynniki wpływające na szybkość przewodzenia
potencjału czynnościowego:
wielkość napływu prądu Na
+
(prąd ten można zmniejszyć obniżając kon-
centrację sodu w płynie międzykomórkowym, zwiększając stopień inak-
tywacji kanałów sodowych - poprzez podwyższenie potencjału błonowe-
go lub działanie środków miejscowo znieczulających. Takie zabiegi obni-
żają prędkość rozchodzenia się potencjału czynnościowego, w skrajnym
przypadku mogą nawet blokować jego rozchodzenie się,
średnica D włókna:
rola otoczki mielinowej. Otoczka mielinowa umożliwia skokowe przemie-
szczanie się potencjału czynnościowego od jednego przewężenia Ranvie-
ra do kolejnego.
~
,
v
D
Wyszukiwarka
Podobne podstrony:
Potencjał czynnościowy mięśniowej komórki roboczej serca1
Przebieg potencjału czynnościowego i kierunki prądów jonowyc
02 potencjaly czynnosciowe i spocz
21 POTENCJAL CZYNNOSCIOWY KOMORKI NERWOWEJid 29105
POTENCJAL CZYNNOSCIOWY id 37876 Nieznany
Potencjał czynnościowy, Prywatne, Studia, Fizjologia
21 POTENCJAL CZYNNOSCIOWY KOMORKI NERWOWEJ
POTENCJAL CZYNNOSCIOWY KOMORKI NERWOWEJ
Prezentacja W04 Potencjal Spoczynkowy WWW
Tabela potencjału czynnościowego, Ratownicto Medyczne, BIOFIZYKA
80 Porownaj kinetyke czasowa potencjalow czynnosciowych znanych ci komorek oraz wezla zatokowo przed
Potencjał czynnościowy komórki roboczej serca
79 Wyjasnij mechanizm powstawania potencjalu czynnosciowego
Cechy potencjału czynnościowego, Pielęgniarstwo, Fizjologia, Neurofizjologia
Potencjal czynnosciowy
Potencjał czynnościowy
potencjał czynnosciowy mechanizm
więcej podobnych podstron