Nazwisko, imię (DRUKOWANYMI LITERAMI) .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
http://sylwester_stepniak.users.sggw.pl
ALKACYMETRIA (II)
e-mail: sylwester_stepniak@sggw.pl
Alkacymetria - jest to metoda ilościowej analizy stechiometrycznej (analizy objętościowej), w której wykorzystuje się reakcje typu: kwas - zasada.
Substancja podstawowa - krystaliczny kwas szczawiowy (H
2
C
2
O
4
·2H
2
O), Masa molowa (M
1
) : M
1
= 126,06 g·mol
–1
.
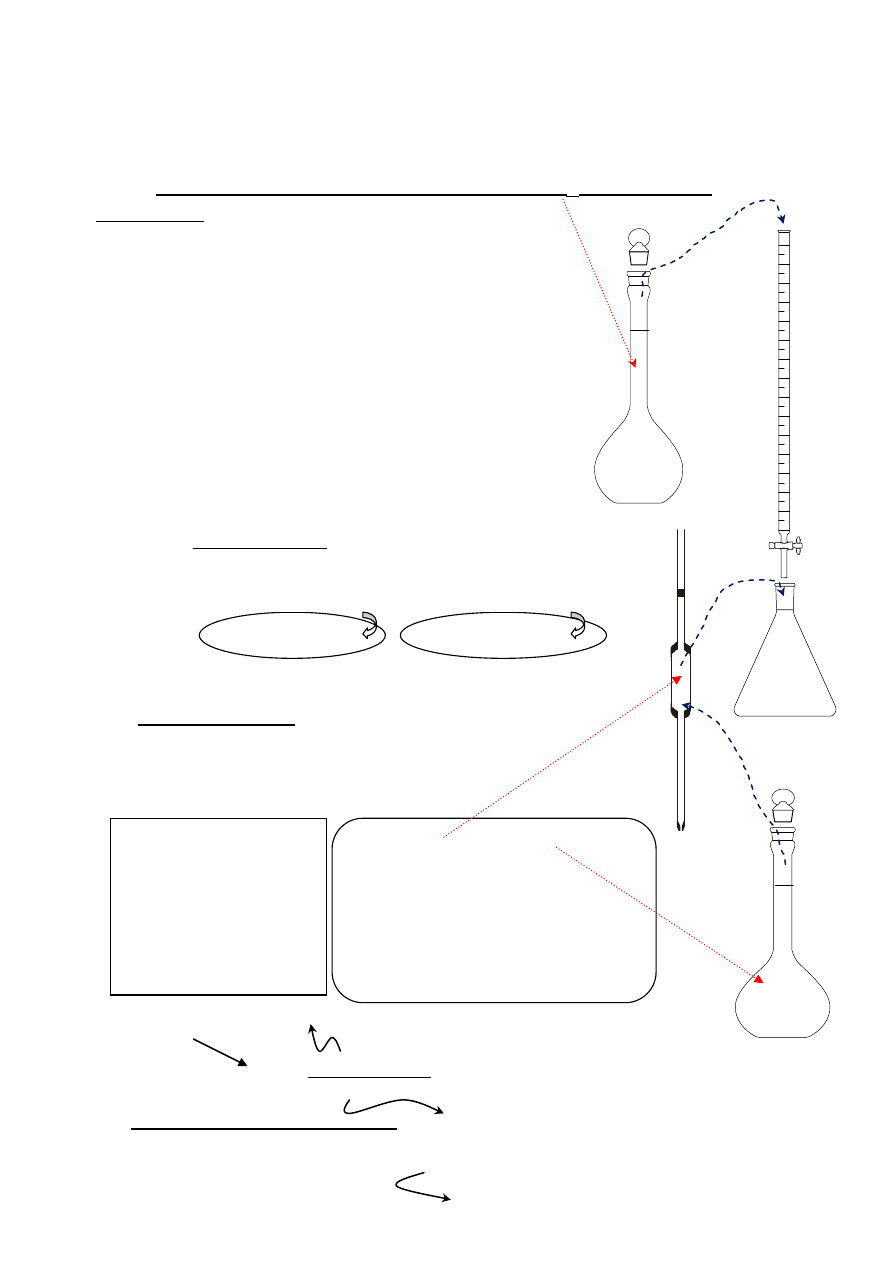
ALKACYMETRYCZNE OZNACZANIE NaOH - METODYKA POSTĘPOWANIA ANALITYCZNEGO
I.
Przygotowanie badanego roztworu NaOH w kolbie miarowej (V
k,2
) do miareczkowania
Objętość pipety w cm
3
III. Obliczenie masy NaOH w badanym roztworze
Odczyt z biurety w cm
3
Masa NaOH w badanym roztworze: m
NaOH
= M
NaOH
·V
k, 2
·c
NaOH
= ..............................................................
Objętość kolby w dm
3
Roztwór bezbarwny
(nadmiar H
2
C
2
O
4
)
Bladoróżowe zabarwienie
roztworu (nadmiar NaOH)
Miareczkowanie mianowanego roztworu kwasu H
2
C
2
O
4
(V
k, 1
)
roztworem NaOH z kolby miarowej (V
k,2
)
H C O
H C O
H O
k
H C O
H O
c
m
V M
2 2 4
2 2 4
2
2 2 4
2
2
2
....................................
Obliczenie stężenia
NaOH
NaOH
H C O
H C O
NaOH r
c
c
V
2 2 4
2 2 4
2 V
ś
,
.........................................
V
NaOH,1
= ........................................
V
NaOH,2
= ........................................
V
NaOH,3
= ........................................
V
NaOH,śr.
= ......................................
NaOH
II.
Oznaczenie stężenia NaOH
Etapy postępowania:
1. Uzupełnić badany roztwór NaOH w kolbie miarowej (V
k,2
) do kreski i dobrze wymieszać.
2. Napełnić biuretę badanym roztworem, wykorzystując lejek plastikowy.
3. Przygotować biuretę do miareczkowania:
- końcówka biurety powinna być wypełniona roztworem bez pęcherzyków powietrza.
- uzupełnić roztwór w biurecie tak, aby menisk roztworu był styczny z kreską zerową.
- wyjąć z biurety lejek.
3. Wyjąć z szafki kolbę miarową z kwasem szczawiowym (V
k, 1
)
i dobrze wymieszać.
4. Pobrać pipetą roztwór kwasu szczawiowego i przenieść ilościowo do kolby stożkowej.
5. Dodać do roztworu z kwasem szczawiowym w kolbie stożkowej 2-3 krople fenoloftaleiny.
6. Postawić kolbę stożkową na białej kartce papieru pod biuretą.
7. Miareczkować roztworem NaOH stale mieszając - do momentu, aż roztwór w kolbie
stożkowej w całej objętości zabarwi się na kolor lekko różowy.
8. Odczytać i zapisać na arkuszu analitycznym
objętość zużytego w czasie miareczkowania
roztworu NaOH.
9. Wykonać 3 takie miareczkowania.
10. Obliczyć:
- średnią objętość zużytego w czasie miareczkowania roztworu NaOH,
- stężenie NaOH w badanym roztworze ( z dokładnością do 4 miejsca po przecinku),
- masę NaOH w badanym roztworze ( z dokładnością do 4 miejsca po przecinku).
Równanie reakcji: H
2
C
2
O
4
+ 2 NaOH
Na
2
C
2
O
4
+ 2 H
2
O
H
2
C
2
O
4
+
Fenoloftaleina
Wskaźnik punktu
równoważności molo-
wej: fenoloftaleina
1.
Pobrać pipetą (V
r
) z kolby miarowej (
V
k, 1
)
roztwór
H
2
C
2
O
4
i przenieść ilościowo do kolby stożkowej.
2. Dodać 2-3 krople fenoloftaleiny do roztworu w kolbie
stożkowej
3. Miareczkować roztworem NaOH (kolba miarowa
V
k,2
) do momentu, aż roztwór w kolbie stożkowej
zabarwi się na kolor różowy, nie znikający przez 30
sekund (po tym czasie roztwór może się odbarwić,
gdyż pochłania z powietrza CO
2
).
Uwaga: Po skończeniu miareczkowań biuretę należy
przepłukać wodą destylowaną.
NaOH
H
2
C
2
O
4
Wyszukiwarka
Podobne podstrony:
Kolos ekonimika zloz II 2 id 24 Nieznany
kolokwium organiczna II id 2408 Nieznany
ASW CANTIUS II id 71219 Nieznany (2)
MGLab Formularz II 5 id 297630 Nieznany
Chemia polimerow II id 113148 Nieznany
Podstawy psychiatrii II id 3681 Nieznany
MGLab Formularz II 4 id 297629 Nieznany
m kawinski cz ii id 274819 Nieznany
Fizyka Ciala Stalego II id 1766 Nieznany
historyczna kolo II id 204904 Nieznany
Bliski wschod II id 90148 Nieznany
Modul II id 305650 Nieznany
Fuzzy Logic II id 182423 Nieznany
Grupa II id 196511 Nieznany
DSW 09 10 kl 2 cz II id 144072 Nieznany
PKM w8 osie waly II id 360039 Nieznany
cwiczenie II id 101091 Nieznany
cw 7 sprawozdanie II id 100281 Nieznany
2A II id 32318 Nieznany
więcej podobnych podstron