KSZTAŁTOWANIE STRUKTURY I WŁAŚCIWOŚCI MATERIAŁÓW
Wykład 1: Cele doboru materiałów i procesu wytwarzania
Znaczenie materiałów
Metale
Polimery
Kompozyty
Ceramika
Klasy materiałów inżynierskich – wyróżnia się 6 rodzin:
METALE (stale, żeliwo, stopy: Cu, Zn. Ti, Al)
POLIMERY (poliestry, epoksydy, fenole, PE, PET, RP, C, PS, PEEK, PA (nylon))
ELASTOMERY (kauczuk naturalny, butylowy, neopren, izopren, silikony, EVA
CERAMIKI (Al
2
O
3
, ZrO
2
, Si
3
N
4
, SiC)
SZKŁA (szkło sodowo-wapniowe, borowo-krzemowe, kwarcowe, tworzywa szklano-ceramiczne)
HYBRYDY (kompozyty, kanapki, struktury segmentowe, siatki, sploty)
Projektowanie - stworzenie produktu efektywnie i bezpiecznie spełniającego swoją funkcję przy rozsądnych kosztach. Polega na
poszukiwaniu najlepszego dopasowania między zespołem własności materiału i zespołem własności wymaganym w projekcie.
TEST WYNIKI TESTU WSZYSTKIE DANE POTENCJALNE ZASTOSOWANIA PRODUKT KOŃCOWY
Dobór procesu jest zależny od własności materiału (formowalności, skrawalności, spawalności, obrabialności cieplnej itd.).
Proces określa kształt, wielkość, dokładność wykonania i koszt wyrobu.
Dobór materiału realizowany zależnie od doboru procesów (kształtowania, łączenia, wykończenia czy innego procesu wytwarzania wyrobu).
Każdy materiał charakteryzuje odpowiedni zespół własności (gęstość, wytrzymałość, odporność na korozję, ciągliwość itd.)
Własności materiału i kształt końcowy wyrobu ograniczają zakres możliwych procesów.
Każdy proces jest charakteryzowany zbiorem własności:
jaki materiał można nim obrabiać,
jakie kształty można nadać i z jaką precyzją,
jak duży i o jakiej złożoności może być wyrób.
Zasady doboru materiałów inżynierskich:
warunki użytkowania muszą być dostosowane do możliwości zastosowanego materiału;
materiał w warunkach eksploatacji powinien być stabilny chemicznie, mechanicznie i cieplnie.
Wykład 2: Klasy materiałów inżynierskich a wiązania chemiczne
Podstawowe klasy materiałów inżynierskich:
metale i ich stopy,
polimery,
materiały ceramiczne,
kompozyty.
Atom składa się z jądra i powłok elektronowych
proton (1,6·10
-19
C; 1,672·10
-24
g)
neutron (1,675·10
-24
g)
elektron (1/1836 masy protonu)
liczba atomowa – Z=ilość protonów
masa atomowa – A=suma protonów i neutronów
Spadek znaczenia (do ok. 1960),
następnie ciągły wzrost
szkła metaliczne
stopy Al.-Li
stale dwufazowe
stale mikroskopowe
nowe nadstopy
powolny rozwój
Przetwarzanie wymagań
projektowych (ustalenie
funkcji, ograniczeń, celów i
zmiennych niezależnych)
FUNKCJA
wywiera mocny wpływ na dobór
materiału i kształtu
PROCES
Własności:
materiał,
kształt i wielkość,
minimalna grubość kształtowanika,
tolerancja i chropowatość, wielkość partii,
nakłady kapitałowe
KSZTAŁT
Kształt określa budowę zewnętrzną (w skali makro) oraz
wewnętrzną (mikrokształt), a jest nadawany w procesie
produkcyjnym obejmującym:
pierwotne procesy kształtowania (odlewanie, kucie,
obróbkę ubytków – skrawanie, wiercienie),
procesy wykończeniowe (polerowani, procesy łączenia,
spawanie)
MATERIAŁ
Rodziny, grupy, podgrupy i
poszczególne materiały
Własności materiałów
Wskaźniki materiałowe i
granice własności
Wszystkie
materiały
Selekcja za pomocą
ograniczeń (eliminacja
materiałów nie
spełniających wymagań)
Ustalenie rankingu
(wyszukanie materiałów
najlepiej spełniających
wymagania)
Poszukiwanie informacji
wspierających (należy zbadać
historię materiałów najlepszych
w rankingu)
Końcowy
dobór
materiału
siły międzyatomowe utrzymują atomy „razem”
F
N
=F
A
+F
R
F
N
– siła wypadkowa działająca między atomami
F
A
– siła przyciągająca
F
R
– siła odpychająca
F
A
r
F
R
Gromadzenie
danych
↓
analiza
statystyczna
↓
wybór materiałów
i procesów
↓
analiza
ekonomiczna
↓
BADANIA
WYBÓR I WDROŻENIE
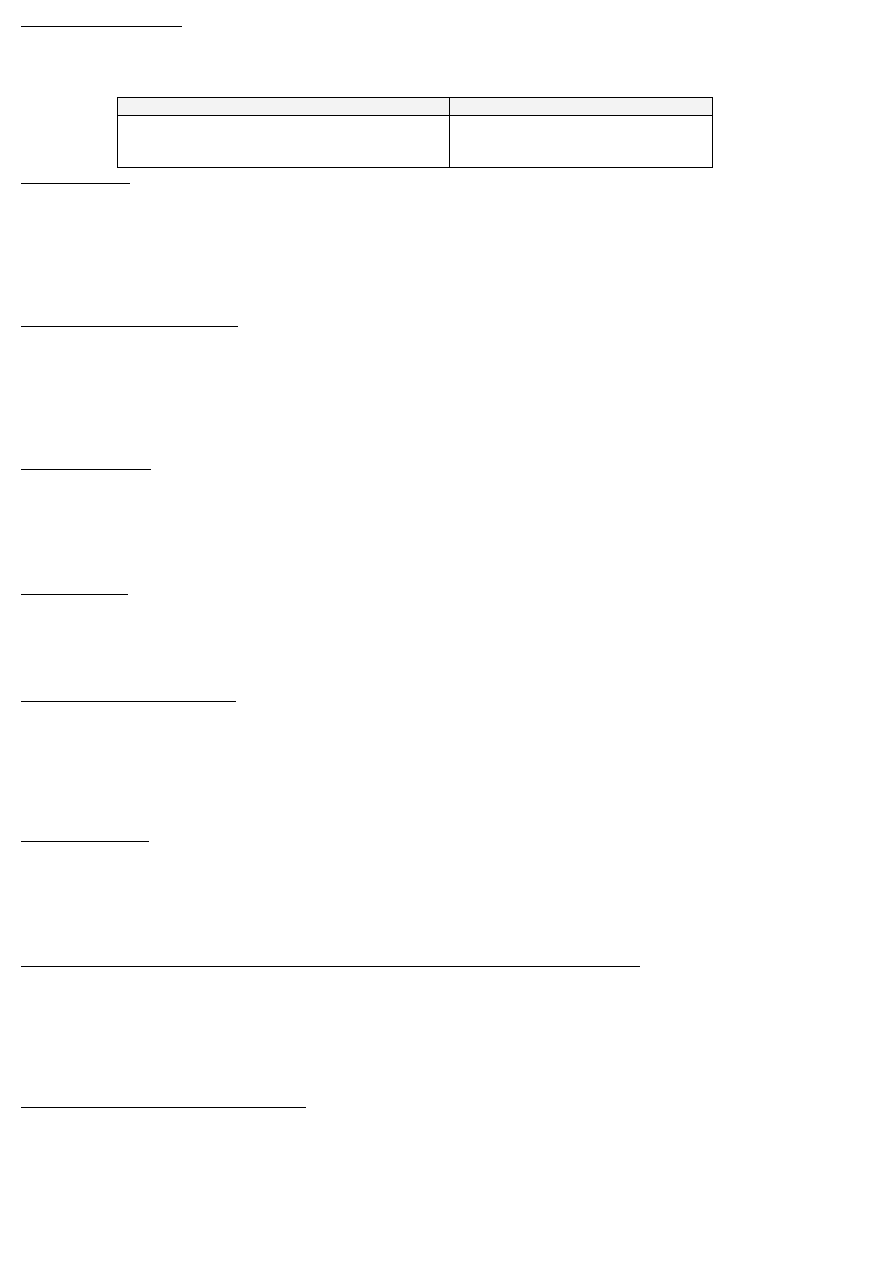
Wiązania między atomami
Wytrzymałość mechaniczna ciał stałych jest wynikiem działania między atomami sił odpychających i przyciągających. Siły te równoważą się
gdy atomy zajmują pozycje równowagowe w kryształach, a pozycjom tym odpowiadają minimalne energie potencjalne. Od nich zależą
określone odległości międzyatomowe (r
0
).
Liczba koordynacyjna – liczba najbliższych atomów/jonów w krysztale
Wiązania pierwotne (silne):
Wiązania wtórne (słabe <40):
jonowe (energia: 600-1550 kJ/mol)
kowalencyjne (500-1250)
metaliczne (100-850)
siły Van der Waalsa
wodorowe
siły Londona
Wiązania jonowe:
Powstaje, gdy elektrony walencyjne jednego atomu elektrododatniego są przyłączane przez drugi atom bardziej elektroujemny.
W wyniku utraty elektronów walencyjnych przez jeden atom i przyłączenia tych elektronów przez drugi, oba atomy uzyskują oktetowe
konfiguracje elektronowe (jakimi charakteryzują się gazy szlachetne).
Tworzone przez atomy, w których występuje odpowiednio brak i nadmiar jednego lub dwóch elektronów walencyjnych.
Siły przyciągania między jonami nie są kierunkowe, a o ułożeniu jonów w materiale decyduje ich wielkość.
Kryształy (jonowe) - przezroczyste, często o różnym zabarwieniu, duża wytrzymałość i twardość, kruchość, tendencja do łupliwości
wzdłuż określonych płaszczyzn, duża rezystywność i oporność cieplna, wysoka T
t
.
Wiązania kowalencyjne (atomowe):
Charakterystyczne w przypadku atomów pierwiastków elektroujemnych (gł. gazów, Si, Ge i diament).
Elektrony walencyjne (pierwotnie różnych atomów) tworzą pary elektronów należące wspólnie do jąder dwóch atomów. Nie jest to zwykłe
nałożenie chmur elektronowych – towarzyszy mu zmiana rozkładu gęstości elektronowej i energii.
kierunkowe, bardzo silne, a posiadające je kryształy są b. twarde i trwałe, wykazują wysoką Tt i dużą Rm, nie przewodzą prądu el., lub
mają własności półprzewodnikowe.
Struktura diamentu – uwspólnione elektrony zajmują obszary rozciągające się ku narożom czworościanu, prowadząc do powstania wiązań
kierunkowych.
Wiązania metaliczne:
Występuje w dużych skupiskach atomów pierwiastków metalicznych, które po zbliżeniu są na wystarczająco małą odległość
(charakterystyczną dla stałego stanu skupienia) oddają swoje elektrony walencyjne na rzecz całego zbioru atomów.
Stosunkowo duża energia
Bezkierunkowe
Elektrony walencyjne przemieszczają się swobodnie pomiędzy atomami (jonami dodatnimi), tworząc tzw. gaz elektronowy –
charakterystyczny dla tego wiązania – stanowi „lepiszcze” (wiążące jony na zasadzie przyciągania elektrostatycznego).
Wiązania wtórne:
Występują między wszystkimi atomami/cząsteczkami, ale ich obecność może być stwierdzona jeżeli występuje przynajmniej jedno z
trzech wiązań pierwotnych.
Słabsze od atomowych (10
3
– 10
4
razy)
Ewidentne między atomami gazów szlachetnych, które mają stabilną strukturę elektronową oraz między cząsteczkami utworzonymi w
wyniku wiązań kowalencyjnych (np. między łańcuchami polimerów).
Wiązania wtórne - Van der Waalsa:
Siły V.d.W. występują między dipolami cząsteczek/atomów, a wiązanie V.d.W. jest wynikiem przyciągania siłami Coulomba między
dodatnim końcem jednego a ujemnym końcem drugiego dipola.
Oddziaływania takie występują między:
atomami obojętnymi elektrycznie,
dipolami wyindukowanymi,
dipolami wyindukowanymi i cząsteczkami spolaryzowanymi (które wykazują dipole okresowo),
cząsteczkami spolaryzowanymi.
Wiązania wodorowe:
najsilniejsze „specjalne” wiązanie wtórne, występuje między spolaryzowanymi cząsteczkami.
wyst. w cząsteczkach, w których wodór jest kowalencyjnie związany z fluorem (HF), tlenem (H
2
O) lub azotem (NH
3
).
W każdym wiązaniu H-F, H-O lub H-N pojedynczy elektron wodoru jest uwspólniony z innym atomem. Wodorowy koniec wiązania jest
naładowany dodatnio przez proton, który nie jest ekranowany przez żaden elektron i jest przyciągany przez przeciwny (ujemnie
naładowany) koniec innej cząsteczki.
Utrzymują cząsteczki wody w stosunkowo dużej odległości wzajemnej (dlatego lód ma mniejsza gęstość niż woda).
Wiązanie wtórne – wiązania między chwilowymi dipolami (wiązanie siłami dyspersyjnymi Londona):
Oddziaływanie dipol chwilowy – dipol indukowany wywołane jest przez ciągłą fluktuację ładunku w cząsteczce/atomie. Mogą one
powodować tym samym tworzenie chwilowych momentów dipolowych, które mogą powodować przyciąganie innych cząsteczek.
Powstają w atomach/cząsteczkach, które normalnie są elektrycznie obojętne.
Siły te powodują skraplanie gazów szlachetnych i wpływają na wzrost ich temp. wrzenia (wraz ze wzrostem liczby atomowej) oraz
wpływają na łączenie się gazów w trwałe cząsteczki (np. H
2
, F
2
– w wyniku oddziaływań wiązania atomowego).
Źródłem wszelkich właściwości oraz potencjalnych aplikacji materiałów inżynierskich są wiązania chemiczne, a zatem konfiguracja
elektronowa tworzących go pierwiastków.
Własności użytkowe materiałów inżynierskich:
Własności fizyczne, mechaniczne, cieplne, elektryczne, magnetyczne czy optyczne materiałów zależne są od:
struktury (na poziomie mikro i makro, elektronowym, krystalicznym),
składu chemicznego oraz
od warunków eksploatacyjnych wytworzonych z nich elementów.
WŁASNOŚCI UŻYTKOWE MATERIAŁÓW INŻYNIERSKICH
Mechaniczne właściwości
objętościowe
Gęstość
Współczynnik sprężystości i tłumienia
Granica plastyczności, wytrzymałości na rozciąganie, twardość
Odporność na pękanie
Wytrzymałość zmęczeniowa, odporność na zmęczenie cieplne
Odporność na pełzanie
Niemechaniczne właściwości
objętościowe
wł. cieplne
wł. optyczne
wł. magnetyczne
wł. elektryczne
Właściwości powierzchniowe
Utlenianie i korozja
Tarcie, ścieralność i zużycie
Właściwości produkcyjne
Łatwość wykonania, łączenia części, obróbka wykończeniowa
Właściwości estetyczne
Wygląd, powierzchnia, forma
Właściwości ekonomiczne
Cena i dostępność
Wykład 3: Metale i ich stopy – struktura, właściwości, metody kształtowania.
Metale wykazują skłonność do tworzenia związków chemicznych o właściwościach raczej zasadowych i nukleofilowych niż kwasowych i
elektrofilowych.
Wypadkowe przyciąganie między elektronami i jonami stanowi wiązanie metaliczne.
Im więcej elektronów swobodnych w sieci krystalicznej, tym lepsze ekranowanie ładunku dodatnich rdzeni atomowych=silniejsze wiązanie,
ale bezkierunkowe.
Właściwości:
stały stan skupienia (wyjątkiem rtęć),
połyskliwe, gładkie powierzchnie w stanie stałym (bardziej reaktywne metale tworzą na powierzchni warstwę tlenków),
ciągliwość i kowalność,
dobre przewodnictwo cieplne i elektryczne,
szybkie wypromieniowywanie ciepła,
z reguły dość wysoka temp. topnienia,
bezwonność.
Gęstość metali zależy od:
promienia atomu (r
a
) objętości komórki elementarnej,
masy atomowej (M
at
),
gęstości upakowania atomów liczby atomów w komórce elementarnej (N
at
).
Temp. topnienia T
p
zalezy od energii wiązania między atomami. W wiązaniu metalicznym energia rośnie wraz ze wzrostem ilości
uwspólnionych elektronów (wiążących) elektronów s i niesparowanych d.
Topnieniu (przejściu ze stanu stałego w stan ciekły) towarzyszy zerwanie wiązań metalicznych.
Rozszerzalność cieplna metali zależna jest od wiązań między atomami (im większa tym rozszerzalność mniejsza).
Właściwości mechaniczne metali
Odkształcenie sprężyste
Odkształcenie plastyczne
Zachodzi łatwo, gdy energia
wiązania jest mniejsza
Trwałe, nieodwracalne przy naprężeniach powyżej granicy
sprężystości/plastyczności R
ε
, wymaga małej siły
Twardość:
to odporność na odkształcenie plastyczne przy nacisku na małą powierzchnię,
miarą - stosunek działającego obciążenia do pola powierzchni odkształcenia,
proporcjonalna do wytrzymałości na rozciąganie: HB=kR
m
.
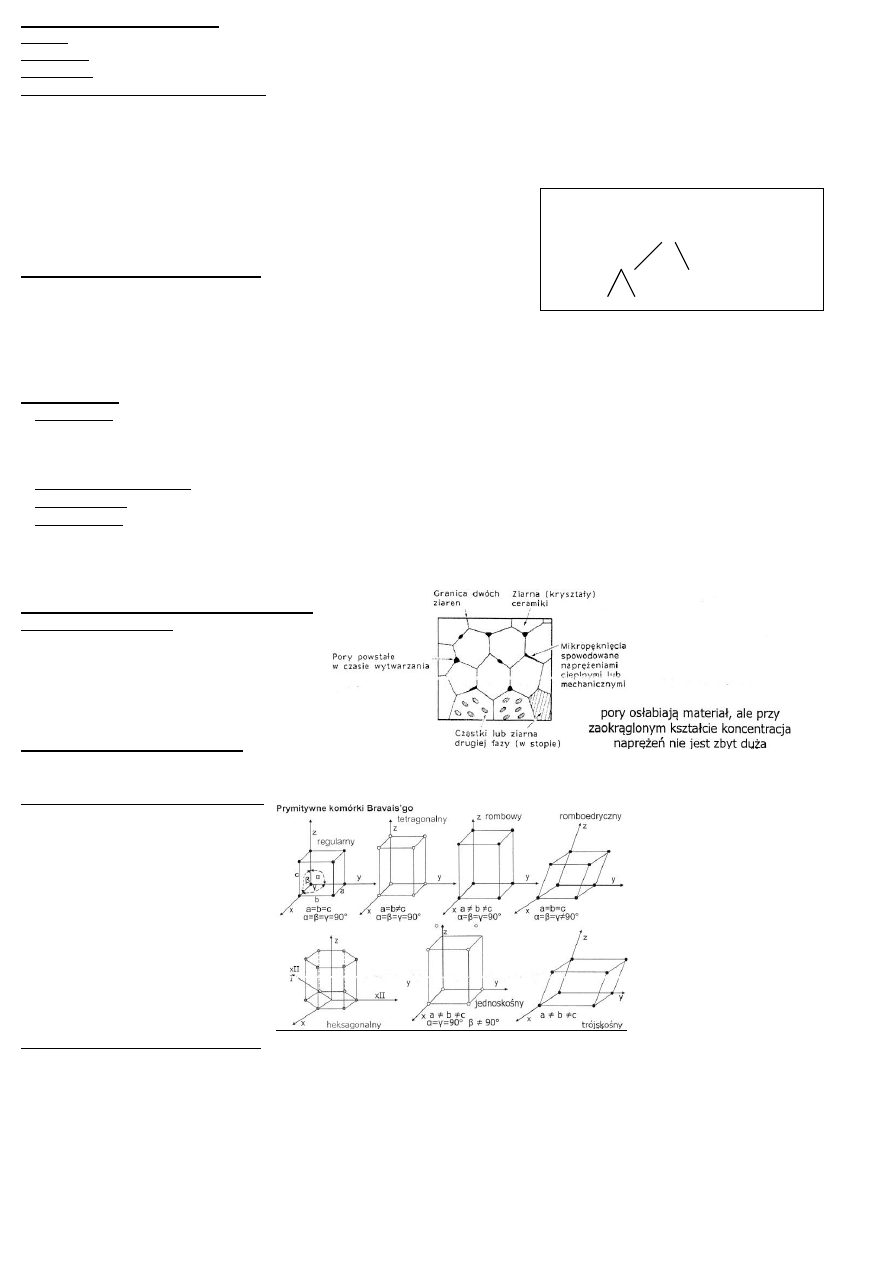
Struktura metali – układy i sieci krystalograficzne:
Atomy w metalach tworzą zwykle sieć krystaliczną o dużej gęstości upakowania i dużych liczbach koordynacyjnych.
Metale nie krystalizują w układach jednoskośnym i trójskośnym.
sieć regularna ściennie centrowana RSC (A1): Feγ, Ag, Cu, Au, Ni, Pt, Pb. 74% objętości upakowania
sieć regularna przestrzennie centrowana RPC (A2):Feα, Crα, W, Mo, V, Nb, Ta. 68% obj. upakowania
sieć heksagonalna zwarta HZ (A3): Mg, Be, Tiα, Coα, Zn, Cd. 74% obj. upakowania
Defekty punktowe w metalach. W kryształach metalicznych występują wszystkie możliwe defekty:
wakans,
obcy atom w węźle,
atomy międzywęzłowe,
dyslokacja unieruchomiona przez defekty punktowe
Defekty punktowe utrudniają ruch elektronów.
Kolor i połysk metali:
Układ pasm energetycznych metali – promieniowanie elektromagnetyczne o prawie każdej energii może być absorbowane przez elektrony,
Elektronów jest bardzo dużo -> światło jest absorbowane w cienkiej, przypowierzchniowej warstwie (grubości 0,1μm), po czym następuje
powrót do stanu podstawowego: elektron emituje foton,
Energia fotonu wyemitowanego= energia fotonu pochłoniętego (dlatego metale b. dobrze odbijają światło w ok. 95%),
działają jak zwierciadło (od niskich częstotliwości do nadfioletu) –> są srebrzyste,
dla promieniowania o b. dużej częstotliwości (X, γ) metale są przezroczyste (bezwładność elektronu jest już za duża by z nim
oddziaływać),
w zakresie od niskich częstotliwości aż do nadfioletu współczynnik odbicia metalu wynosi~1 (->kolor wszystkich metali-szary).
Avog
el
kom
at
at
N
V
M
N
.
.
ρ-gęstość
V
kom.el.
– objętość kom. elementarnej
N
Avog.-
liczba Avogradra 6,022·10
23
mol
-1
naprężenie:
odkształcenie:
]
[Pa
S
F
[%]
L
L

Opór metalu rośnie wraz z temperaturą oraz z zawartością defektów.
Rezystywność metali:
Właściwości metalu a budowa krystaliczna
Niektóre metale mogą mieć kilka struktur krystalicznych – odmian alotropowych (np. Fe, Ti).
Polimorfizm – wielość struktur krystalicznych.
Zmiana ułożenia atomów Fe skutkuje zmianą własności (np. mechanicznych, chemicznych i fizycznych).
Struktura a właściwości metali
Jeśli ciekły metal zostanie bardzo szybko ochłodzony, atomy zajmujące przypadkowe pozycje w stanie ciekłym nie zdążą się przegrupować
tak, aby uzyskać sieć krystaliczną. Zamiast niej powstaje szklisty/amorficzny układ atomów, w którym atomy są zamrożone w pozycjach
charakterystycznych dla stanu ciekłego.
Metale tego typu – szkła metaliczne, ich struktura - gęsty przypadkowy układ sztywnych kul (nieuporządkowana struktura, gęstość
upakowania ~64%, niska topliwość, wytrzymałość mechaniczna, plastyczność, magnetyzm).
Polikrystaliczna struktura metali
Metale rzadko wykazują strukturę monokryształów.
Metale techniczne otrzymywane metodami metalurgicznymi – to zwykle polikryształy.
Ziarna – części kryształu o prawidłowej strukturze krystalicznej o osiach nachylonych względem siebie o kąt dezorientacji (kąt powstały
między głównymi kierunkami dwóch sąsiednich ziaren).
Przypadkowa orientacja ziarn (z których każde ma prawidłową strukturę krystaliczną), decyduje o niemal jednakowych własnościach metali
w różnych kierunkach (są więc quasi-izotropowe, a wzrost wielkości ziarn wpływa na zwiększenie anizotropii tych własności).
Stopy metali – substancje dwu- lub wieloskładnikowe, makroskopowo wykazujące właściwości metaliczne. Co najmniej jeden z głównych
składników stopu jest metalem, a pozostałe to dodatki, substancje proste (pierwiastki) lub złożone (nie ulegające przemianom związki
chemiczne).
Dodatki stopowe rozpuszczają się w sieci danego metalu tworząc roztwór stały, gdzie rozpuszczalność składników zmienia się od
0,01 – 100% (zależnie od kombinacji pierwiastków).
Stopy metali wytwarza się głównie przez topnienie i krystalizację ze stanu ciekłego.
Skład chemiczny stopów wyrażany jest jako:
stężenie masowe składników,
stężenie atomowe składników.
Stopy mogą mieć strukturę jedno- lub wielofazową
Faza – część układu jednorodna pod względem składu chemicznego i własności mechanicznych oddzielona od pozostałej części układu
granicą fazową.
poszczególne fazy stopu różnią się między sobą własnościami,
liczba, rodzaj i własności faz zależą od składu chemicznego stopu,
układ- zbiór faz znajdujących się w stanie równowagi termodynamicznej,
roztwór stały – jednorodna faza o wiązaniu metalicznym i strukturze krystalicznej o własnościach typowo metalicznych,
rozpuszczalnik– metal, którego atomy występują w sieci w przewadze, drugi składnik – substancja rozpuszczona.
Rodzaje faz występujące w stopach metali:
1. Roztwory stałe
2. Związki chemiczne
3. Fazy międzymetaliczne
Roztwory stałe mogą być:
podstawowe –rozpuszczalnikiem jest pierwiastek będący składem stopu,
Zachowują strukturę sieciową taką, jak czysty metal rozpuszczalnik. W zależności od zakresu stężenia składnika rozpuszczonego dzielą
się na:
graniczne – jeżeli jego stężenie jest ograniczone w pewnym zakresie,
ciągłe – w przypadku nieograniczonej rozpuszczalności obydwu składników w całym zakresie stężeń 0-100%.
wtórne – rozpuszczalnikiem faza międzymetaliczna.
Reguły Hume-Rothery’ego (tworzenie roztworów stałych ciągłych):
I. Typów sieci: oba składniki mają ten sam typ struktury krystalicznej.
II. Wielkości atomów: całkowita rozpuszczalność przy stosunku promieni atomowych <1,08 tylko ograniczona dla >1,15.
III. Elektrowartościowości ujemnej: im mniejsza różnica elektrowartościowości, tym większa możliwość tworzenia roztworów stałych.
IV. Względnych wartościowości: dla miedziowców rozpuszczalność metali o wyższej wartościowości w metalach jednowartościowych jest
większa niż odwrotnie.
Jeżeli atomy pierwiastka rozpuszczonego usytuowane są w sposób nieuporządkowany w przestrzeniach sieci metalu rozpuszczalnika powstają
roztwory stałe międzywęzłowe.
Jeżeli atomy metalu zajmują przypadkowo dowolne węzły w sieci krystalicznej powstają roztwory stałe różnowęzłowe (odkształcenia sieci:
ekspansja i kontrakcja). W roztworze tym, o określonym stężeniu oraz w wyniku wolnego chłodzenia/wygrzewania w stałej temp. może
zachodzić przemiana: nieporządek-porządek (tworzy się NADSTRUKTURA – nieodwracalna, po nagrzaniu do określonej temp. -zanik).
Związki chemiczne – mają określoną temp. topnienia i odrębne właściwości fizyczne, chemiczne i mechaniczne od tworzących je
składników. Ich tworzenie zachodzi najczęściej pomiędzy metalami a pierwiastkami niemetalicznymi (np. O
2
, Cl, S), a wiązania mają głownie
charakter jonowy. Występują one w stopach metali jako wtrącenia metaliczne.
Fazy międzymetaliczne – połączenia metali lub metali z niemetalami, mają metaliczny lub złożony charakter wiązań międzyatomowych
(->metaliczne właściwości), oraz mają często zmienny skład ilościowy. Mają strukturę krystaliczną odrębną od tworzących ją składników,
uporządkowany układ atomów w sieci przestrzennej. Można określić ich wzór stechiometryczny tak jak w związkach chemicznych
(traktowane więc jako roztwory stałe na osnowie związków chemicznych). Fazy międzymetaliczne w stopach:
struktura krystaliczna różna od struktury każdego ze składników,
d
t
ρ
t
- rozpraszanie (zmniejszenie ruchliwości)
elektronów przez cieplne drgania rdzeni
atomowych w węzłach sieci
ρ
d
– rozpraszanie
elektronów na defektach
(zwłaszcza punktowych)
Dodatni temperaturowy współczynnik rezystancji

uporządkowane rozmieszczenie atomów,
przewaga wiązania metalicznego,
wzory podobne do wzorów zw. chem. przy braku związku z wartościowością pierwiastków; odchylenia od stechiometrii,
roztwory stałe wtórne: różno węzłowe, międzywęzłowe, pustowęzłowe,
klasyfikacja wg stężenia elektronowego lub wielkości atomów.
Fazy elektronowe
Stężenie elektronowe: stosunek liczby elektronów wartościowości do liczby atomów w komórce elementarnej (czynnik
elektrochemiczny)
Roztwory stałe wtórne o wyraźnych właściwościach metalicznych
możliwe stężenia elektronowe: 21/14, 21/13, 21/12.
Umocnienie stopów cząstkami faz wtórnych
Spowodowane przez różnice między cząstkami a osnową: struktury sieciowej, składu chemicznego, własności sprężystych
i wytrzymałościowych
Utwardzanie wydzieleniowe: cząstki faz wydzielają się w osnowie przy tworzeniu koherentnej granicy międzyfazowej, sprężystego
odkształcenia sieci i pola naprężeń dalekiego zasięgu; może nastąpić częściowe zerwanie koherencji i zmniejszenie granicy
plastyczności
Utwardzanie dyspersyjne: cząstki faz są wprowadzane w procesie wytwarzania; występuje granica niekoherentna
Wykład 4: Stopy metali Cd.
Stop - tworzywo metaliczne, powstałe w wyniki dodania innych pierwiastków – składników stopowych do czystego metalu, np.: mosiądz – Cu
+ Zn; monel – Ni + Cu. Składnikami stopu są pierwiastki, które go tworzą, opisane symbolami chemicznymi. Stop podwójny ma 2 a potrójny
3 składniki.
Faza – część objętościowa stopu o jednorodnych właściwościach fizycznych i chemicznych, oznaczana literami greckiego alfabetu
,
.
Skład chemiczny stopu albo fazy w stopie podaje się w % wagowych (W), np.: dla stopu układu A-B
%
100
B
skłkładni
masa
A
skłkładni
masa
A
skłkładni
masa
W
A
%
100
B
skłkładni
masa
A
skłkładni
masa
B
skłkładni
masa
W
A
Albo jako procent atomowy lub molowy X poszczególnych składników:
%
100
B
atomów
liczba
A
atomów
liczba
A
atomów
liczba
X
A
Stan stopu opisuje się przez:
średni skład chemiczny;
liczbę faz;
skład chemiczny każdej z faz
udział wagowy poszczególnych składników.
Dany stop znajduje się w fazie równowagi termodynamicznej, jeśli nie ma zmiany tendencji zmiany fazowej w funkcji czasu. Układy
równowagi lub układy równowagi faz stanowią sumę stanów wszystkich składników układu stopu.
Równowaga termodynamiczna
Stan równowagi: gdy układ osiąga min. Energii swobodnej lub gdy wystąpi równość potencjałów chemicznych składników tworzących
fazy (nie ma wówczas przepływu przez granice fazowe)
Energia swobodna Helmoholtza: F = E – TS, gdzie E – en. wewnętrzna, T – temp. bezwzględna, S – entropia
En. wewnętrzna E układu jest sumą energii potencjalnej, tj. energii wzajemnego oddziaływania, i energii kinetycznej wszystkich atomów
układu (w kryształach znaczna część energii E wiąże się z drganiami atomów w sieci.
temp. powoduje
amplitudy wychyleń i
E o
E). Zmiana en. wew.:
E =
Q +
W, gdzie:
Q – przyrost ciepła,
W – przyrost prcy.
Entropia S jest funkcją stanu i określa równowagę układu gdy
S = O oraz kierunek przemiany
Zmiana entropii:
S = -
Q/T
Zarówno E jak i S są własnościami pojemnościowymi, więc są proporcjonalne do ilości materiału.
Gdy układ znajduje się w stałej temp. i działa na niego stałe ciśnienie po ustaleniu się równowagi i energia swobodna Gibasa G jest
minimalna: G = E + pV –TS
Procesy metalurgiczne zachodzące przy stałym ciśnieniu wymagają rozpatrywania energii swobodnej Gibsa, a nieznaczne zmiany
objętość umożliwiają pomijanie czynnika pV i rozpatrywanie energii swobodnej Hlmoholtza F.
Entalpia – opisuje funkcję stanu przy stałym ciśnieniu: H = E + pV
Równowaga faz – reguła faz Gibasa
Regułą faz Gibasa mówi, że: suma maksymalnej liczby faz f, które mogą współistnieć w układzie w stanie równowagi oraz liczby stopni
swobodnych S jest równa liczbie niezależnych składników układu n powiększonej o dwa.
Liczba stopni swobodnych (temp., ciśnienie, stężenie składników)
f + s = n + 2 lub s = n - f +2 (s = n – f + 1)
Równowaga czterech i więcej faz w układach dwuskładnikowych jest niemożliwa (p = const.)
Równowaga trzech faz w tych układach jest możliwa w stałej temperaturze przy określonym stężeniu składników w fazach (eutektyki
lub perytetyki)
Dwie fazy są w równowadze nawet przy zmianie bądź stężenia składnika w fazie, bądź temperatury.
Dla jednej fazy możliwa jest zmiana i stężenia i temperatury.
Dwuskładnikowy układ z nieograniczoną rozpuszczalnością w stanie stałym
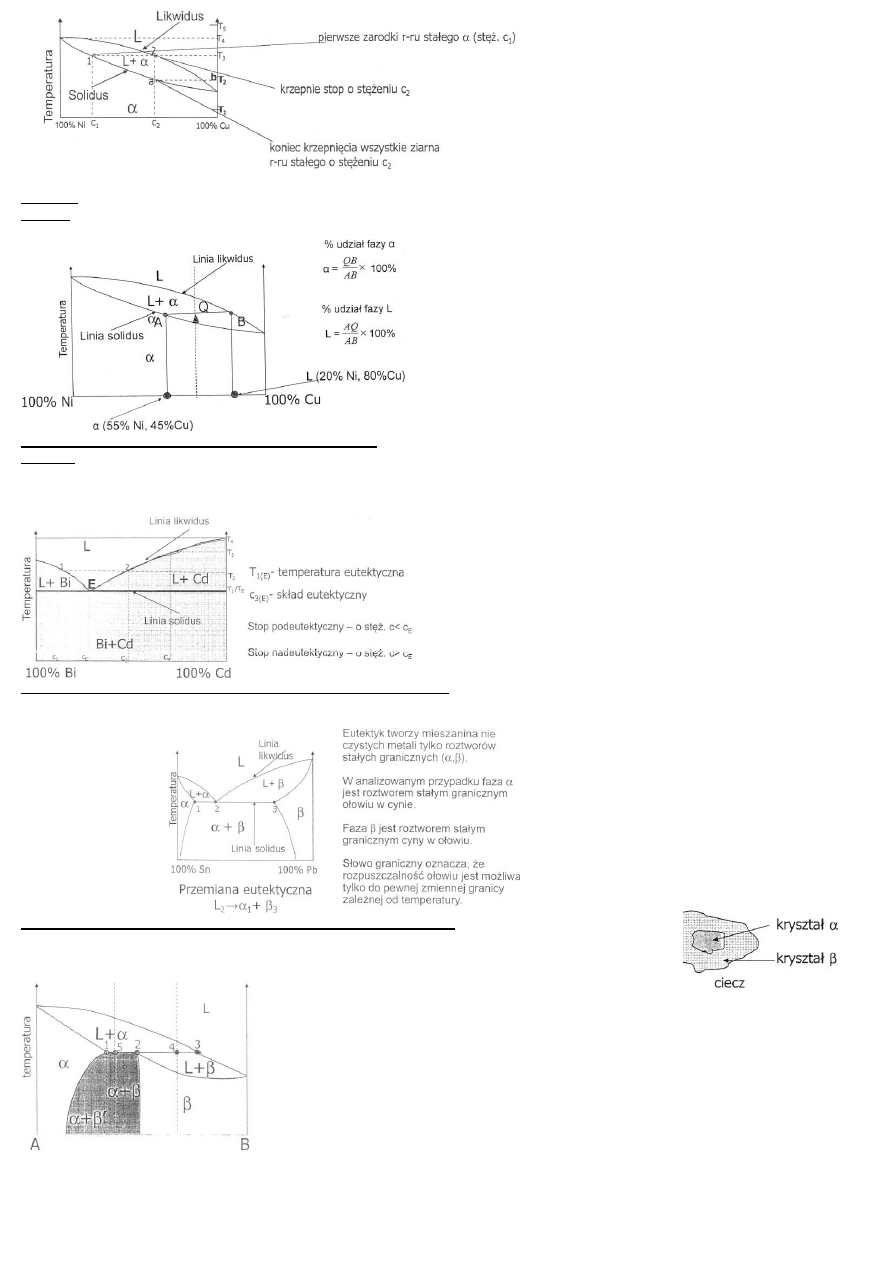
W temperaturze perytektycznej stop jest złożony z mieszaniny cieczy i kryształów r-ru stałego.
Ciecz o stężeniu c
L
reaguje z wydzielonymi kryształami r-ru stałego
, w wyniku czego
powstają kryształy r-ru stałego
.
Przemiana ta zachodzi aż do wyczerpania się cieczy!!!
Przemian perytektyczna
1
+ L
3
2
przebiega w stałej temperaturze!
Likwidus – linia temp., powyżej której stopy w całym zakresie stężeń są ciekłe.
Solidus – linia oznaczająca wartości temp., poniżej których stopy w całym zakresie stężeń występują w stanie stałym
Układ bez rozpuszczalności w stanie stałym z eutektyką
Eutektyk, czyli mieszanina faz, nap.: czystych metali bizmutu i kadmu, która krzepnie zawsze z cieczy w stałej, najniższej temperaturze. Może
występować w postaci na przemian ułożonych płytek lub słupków.
Takie układy praktycznie nie występują, stosuje się je do analizy stopów metali o małej wzajemnej rozpuszczalności składników w stanie
stałym!
Układ z ograniczoną rozpuszczalnością w stanie stałym i eutektyką
Układy te są tworzone przez pierwiastki o jednakowych lub różnych sieciach krystalograficznych, różniących się promieniami atomowymi
więcej niż o 15%.
Układ z ograniczoną rozpuszczalnością w stanie stałym i perytetyką
Układy te są tworzone przez pierwiastki o jednakowych lub różnych sieciach krystalograficznych,
różniących się promieniami atomowymi więcej niż o 15%.
Dwuskładnikowe układy z fazą międzymetaliczną występują bardzo często, mogą zawierać nie tylko jedną, ale i kilka różnych faz.
Przykład: F. międzymetaliczna będąca roztworem wtórnym oraz dwoma eutektykami. Utworzone fazy między metaliczne są nietrwałe i mogą
ulegać przemianą fazowym pod wpływem obniżania temperatury. Niektóre z faz ulegają uporządkowaniu w nadstrukturę (np. Cu-Zn) lub
rozpadowi eutektoidalnemu na dwie różne fazy.
Faza
jest roztworem stałym ciągłym, której skład
chemiczny może się zmieniać w sposób ciągły od 0 do 100%
Ni (różnowęzłowym). Pod mikroskopem ziarna fazy
wyglądają tak samo niezależnie od składu chemicznego.
Stopy krzepnące w warunkach technicznych
charakteryzują się znaczną niejednorodnością
składu chemicznego w obrębie ziaren.
Regułą faz s = n – f + 1
Wzrost szybkości chłodzenia cieczy powoduje rozdrobnienie
eutektyki (mniejsza grubość płytek) co powoduje wzrost
własności mechanicznych, np. twardości, wytrzymałości na
rozciąganie, czy udarności.
Żelazo
Odmiany alotropowe:
( < 912
o
C )
( 1394 – 1538
o
C )
( 912 – 1394
o
C )
Grafit
Każdy atom C wykorzystuje tylko 3 z 4 możliwych wiązań kowalencyjnych, tworząc równoległe warstwy o symetrii heksagonalnej –
lk = 3
Heksagonalna sieć krystaliczna powstaje w wyniku powiązania tych warstw słabymi siłami van der Waalsa, w. w. = 16,9% (b. mały),
B. miękki (łatwość przemieszczania się warstw),
Wysoka wytrzymałość tylko wzdłuż równoległych płaszczyzn heksagonalnych – włókna węglowe
Temp. topnienia 3900
o
C, ale niska odporność erozyjna
Właściwości wytrzymałościowe grafitu są tak małe, że traktujemy jego wydzielenia jako nieciągłości osnowy metalowej stopu
O właściwościach stopów z grafitem (żeliwa szare) decyduje jego kształt, wielkość i rozmieszczenie
Definicje faz układu Fe – Fe
3
C
Ferryt
jest roztwór stały (graniczny) węgla w żelazie
Fe
(C), o maksymalnej rozpuszczalności węgla 0,0218% w temp. 727
o
C.
Twardość ferrytu od 70 do 90HB. Struktura A2
Austenit
- roztwór stały graniczny węgla w żelazie Fe
Fe
(C) o maksymalnej rozpuszczalności węgla 2,11% w temp. 1148
o
C. Faza
miękka i plastyczna. Wysteruje w temp. powyżej 727
o
C. Struktura A1
Cementyt Fe
3
C – faza międzymetaliczna (węglik żelaza). Zawartość węgla w cementycie wynosi 6,67%. Jest twardy (750 HB) i kruchy
(f. metastabilna).
I - rzędowy – wydziela się z fazy cieczy przy chłodzeniu
II - rzędowy – wydziela się podczas chłodzenia z austenitu
III - rzędowy – wydziela się z ferrytu podczas chłodzenia.
Definicje składników strukturalnych
Ledeburyt – mieszanina eutektyczna austenitu i Fe
3
C, powstaje z cieczy o składzie zaw. 4,3%C w stałej temp. 1148
o
C.
Perlit jest to mieszanina eutektoidalna (powstaje z fazy stałej) ferrytu i cementytu lub z austenitu o zawartości 0,77% C w stałej t emp. 727
o
C.
Definicja stali
Stal – plastycznie (ewentualnie cieplnie) obrobiony stop żelaza z węglem i innymi pierwiastkami, otrzymywany w procesach stalowniczych
ze stanu ciekłego. Stal może zawierać do 2% węgla, powyżej tej wartości występuje żeliwo.
węglowe (niestopowe) – własności zależą od węgla, który decyduje o własnościach mechanicznych. Pozostałe pierwiastki pochodzą
jedynie z przerobu hutniczego (krzem, mangan, aluminium) lub są zanieczyszczeniami (fosfor, siarka, tlen wodór, azot, cyna, antymon,
arsen).
stopowe, do których celowo wprowadza się pierwiastki stopowe, aby nadać im wymagane własności, np.: mangan, krzem, chrom, nikiel.
Wolfram, molibden, wanad; rzadziej stosuje się aluminium, kobalt, miedź, tytan, tantal, niob, a w niektórych przypadkach i azot.
Rola domieszek i pierwiastków stopowych
Domieszki:
Mangan: powoduje gruboziarnistość
Krzem: przeciwdziała segregacji fosforu i siarki
Fosfor i siarka: powodują kruchość stali
Wodór: pogarsza własności stali, powoduje powstawanie pęcherzy i płatków śnieżnych.
Azot: powoduje spadek plastyczności
Tlen: powoduje spadek własności mechanicznych
Pierwiastki stopowe
Wywołanie określonych zmian strukturalnych
Zwielokrotnienie (poprawa) własności
Wzrost hartowności
Ułatwienie obróbki cieplnej
Źródła: tworzenie roztworów stałych i faz międzymetalicznych oraz międzywęzłowych, zmiany punktów charakterystycznych wykresu Fe-
C
Stale stopowe
Ze względu na sumaryczne stężenie pierwiastków stale stopowe dzielimy na następujące grupy:
Niskostopowe – stężenie jednego pierwiastka (oprócz C) nie przekracza 2%, a suma pierwiastków łącznie nie przekracza 3,5%
Średniostopowe – stężenie jednego pierwiastka (oprócz C) przekracza 2%, lecz nie przekracza 8% lub suma pierwiastków łącznie nie
przekracza 12%
Wysokostopowe – stężenie jednego pierwiastka przekracza 8% a ich łączna suma przekracza 55%.
Klasy jakości stali niestopowych (węglowych)
Stale niestopowe ze względu na klasy jakości dzielimy na:
Jakościowe – wszystkie, które nie zaliczają się do stali specjalnych
Specjalne – te, które spełniają jeden lub więcej z warunków:
Wymagana praca łamania w stanie ulepszonym cieplnie;
Wymagana głębokość utwardzania powierzchniowego lub twardości powierzchni po hartowaniu;
Niski udział wtrąceń niemetalicznych
Max stężenie fosforu i siarki 0,020%
Przewodność elektryczna właściwa 9 S*m/mm
2
Klasy jakości stali stopowych
Ze względu na jakości stele stopowe dzielimy na:
Stopowe jakościowe, wyróżnia się następujące grup:
Konstrukcyjne spawalne,
Na szyny, grodzice, kształtowniki na obudowy górnicze,
Na produkty płaskie walcowane na zimno lub na gorąco
Przeznaczone do dalszej obróbki plastycznej na zimno
Elektrotechniczne
Z miedzią
Stopowe specjalne – obejmują one wszystkie gatunki stali, które nie zostały ujęte w klasie stali nierdzewnych oraz stopach jakościowych.
Stale stopowe specjalne
Stale stopowe specjalne dzielą się na podklasy:
Maszynowe (do budowy maszyn)
Na urządzenia ciśnieniowe,
Konstrukcyjne,
Szybkotnące
Na łożyska toczne
szczególnych własnościach fizycznych.
Stale stopowe nierdzewne – należą do nich stale zawierające co najmniej 10,5% Cr oraz co najwyżej 1,2% C, a są dzielone na:
Odporne na korozję,
Żaroodporne,
Odporne na pełzanie (żarowytrzymałe)
Wykład 5: Tworzywa ceramiczne – skład, budowa, właściwości
Ceramika (tworzywo ceramiczne) – nieorganiczny, niemetaliczny i zagęszczony materiał na osnowie związków niemetali XIII-XVI grupy
UOP, z sobą z dowolnymi metalami. Materiał, zazwyczaj polikrystaliczny, otrzymywany jest za pośrednictwem procesów wytwórczych
zapewniających transport masy i doprowadzający do wiązania składników wyjściowych. W skład materiałów ceram. Wchodzą, O, Si, Al., Ca,
Na, K, Mg, Ti, N najbardziej rozpowszechnione pierwiastki skorupy ziemskiej i atmosfery! Surowcami wyjściowymi poza kopalinami
mineralnymi (gliny, kaoliny, itp.) są również surowce syntetyczne: borki, węgliki, azotki, tlenki, krzemki, fosforki, siarczki, selenki, i inne
związki na ich bazie.
Budowa wewnętrzna ceramiki
Jonowy i kowalencyjny charakter wiązań wpływa na:
Twardość i odporność na ścieranie
Kruchość
o Kruche pękanie na skutek działania obciążę mech. Lub naprężeń cieplnych (zachodzi na pustkach porach, rysach, defektach
sieci – ich liczba, wielkość i rozmieszczenie są zmiennymi losowymi)
o
Wytrzymałość mech. Ceramiki może się zmniejszać z upływem czasu, bez działania naprężeń cyklicznych (zmęczenie
statyczne, silnie zależy od rodzaju środowiska pracy)
o
Duża wytrzymałość na ściskanie, ale mała na rozciąganie.
Wysoką temperaturą topnienia
Małą przewodnością cieplną i elektryczną (są wyjątki!)
Dobrą stabilność chemiczną i cieplną.
Wiązania chemiczne w ceramice
Udział wiązania jonowego i kowalencyjnego determinuje strukturę krystaliczną.
Jonowe - idealne wiązanie powstaje, gdy jeden z atomów całkowicie oddaje swoje elektrony, a występuje dzięki oddziaływaniu
elektrostatycznemu atomów. Jest mało wytrzymałe, rozerwanie polega na oddaleniu anionu i kationu na odległość, dla której nie będzie
oddziaływania elektrostatycznego. Jeżeli różnica elektroujemności jest mała, to oktet elektronowy jest rozciągnięty. Wiązanie jonowe powstaje
m.in. w MgO, Cao, Al
2
O
3
, ZrO
2
.
Kowalencyjne – powoduje powstanie anionów i kationów. Idealne tworzą atomy tego samego pierwiastka, poprzez wspólny oktet elektronowy
– powstaje polaryzacja. Wiązanie to tworzą węgliki (TiC, Sic), azotki (Si
3
N
4
), AIN) i SiO
2
, jest sztywne i silne, a materiały twarde, ze względu
na zagęszczenie materii.
Podział tworzyw ceramicznych
Ceramika krystaliczna – regularne i powtarzalne ułożenie atomów (tradycyjne krzemiany, wiele tlenków, związki nie zawierające tlenu –
azotki, węgliki, borki)
Szkła – skład zbliżony do ceramiki krystalicznej, ale bez uporządkowania dalekiego zasięgu (należy traktować jako nieskrystalizowaną
ceramikę, określenie ‘przechłodzona ciecz’ jest niepoprawne!)
Ceramika szklana (dewitryfikaty) – kształtowane w stanie szklistym, a następnie krystalizowane w wyniku obróbki cieplnej.
Ze względu na strukturę mażna wyróżnić ceramikę:
Jonową i kowalencyjną - w zależności od przeważającego wiązania.
Litą i porowatą;
Jednofazową lub wielofazową;
Drobnoziarnistą lub gruboziarnistą.
Podział tworzyw ceramicznych
Ceramika może występować w postaci objętościowej, warstw i pokryć, które zostały otrzymane zgodnie z założeniami teoretycznymi i mogą
samodzielnie wypełniać użyteczną funkcję.
jonowe
Mieszane
kowalencyjne
Niemetale
Ceramika
Ceramika
tradycyjna
- Ceramika szlachetna
- Ceramika budowlana
- Materiały ogniotrwałe
- Szkła i emalie
- Materiały izolacyjne
Ceramika zaawansowana
Ceramika funkcjonalna
Ceramika strukturalna
- drobnoziarnista
- nowoczesna
- techniczna
Ceramika zawansowana
Jednofazowa
Porowat
a
Gęsta
Wielofazowa
Porowat
a
Gęsta
Laminaty i włókniste
Podział pod względem udziału faz:
Ceramika specjalna
Tlenkowa
Nietlenkowa
Proste tlenki
Krzemiany
Wg kryterium dominującego związku chemicznego
Klasyfikacja ceramiki – składy
Fazowy – np. faza krystaliczna, szklista, gazowa lub różne fazy krystaliczne
Chemiczny – pierwiastkowy, tlenkowy, molowy i In.
Surowcowy – surowce mineralne lub głęboko przetworzone – tlenki i materiały syntetyczne.
Klasyfikacja ceramiki zaawansowanej
Podział pod względem składu chemicznego:
Tlenkowe: Al
2
O
3
, ZrO
2
, BeO, MgO, CaO
Krzemianowe: porcelana elektrotech., multi, steatyt, kordieryt
Węglikowe: Sic, B
4
C, TiC, węgliki spiekane
Azotkowe: Si
3
N
4
, BN, Tin, SIALON (azotek krzemu z tlenkiem glinu)
Borkowe: TiB
2
Krzemkowe: MoSi
2
Węglowe i grafitowe
Szkła specjalne
Klasyfikacja a zastosowanie ceramiki
Klasyfikacja uwzględniająca podstawowe cechy:
Naturę – nieorganiczna, organiczna;
Stan – proszek, włókno, warstwa, zagęszczony materiał;
Skład – pierwiastki, związki;
Strukturę – krystaliczna, amorficzna
Sposób wytwarzania – technologia.
Skład ceramiki
Wzór Segera – za pomocą ułąmków molowych tlenków tworzących dany układ; podzielone na tlenki alkaliczne R
2
O (K
2
O, Na
2
O, Li
2
O itp.),
Zasadowe RO (CaO, MgO, PbO, SrO, SnO, ZnO itp.), a sumę ich ułamków molowych sprowadza się do 1 (R
2
O + RO = 1) i oblicza się
odpowiadającą im ilość tlenków amfoterycznych R
2
O
3
(Al
2
O
3,
Fe
2
O
3
, Cr
2
O
3,
Mn
2
O
3
itp.). oraz kwaśnych RO
2
, (Si O
2,
TiO
2
, Zr O
2
, Sn O
2
oraz B
2
O
3
, i P
2
O
3
. 1(R
2
O + RO)*mR
2
O
3
*nRO
2
Tl. Alkaliczne i zasadowe – topniki, ich działanie zależy od temp. i innych składników
Tl. Amorficzne – podwyższają temperaturę topnienianp. Al
2
O
3
, Cr
2
O
3
, SiO
3
.
Wzór Bogue’a – stosowany do określania składu mineralnego klinkieru cementowego (produkt przejściowy do otrzymywania cementu
portlandzkiego), rozpatrywany jako 2 ukłądy trójskładnikowe: CaO–SiO
2
– l
2
O
3
i CaO-Al
2
O
3
- Fe
2
O
3
. Zamiast wzorów stosuje się pierwsze
litery: CaO
C, SiO
2
S, Al
2
O
3
A, Fe
2
O
3
F.
Podczas wypalania mieszaniny surowców powstają krzemiany: C
3
S – trójwapniowy alit; C
2
S – dwuwapniowy belit oraz fazy ferrytowe o
zmiennym składzie (np. C
4
AF, C
6
AF, C
2
F)
Model mikrostruktury ceramiki krystalicznej
Mikrostruktura ceramiki:
Faza krystaliczna
Faza szklista
Faza gazowa
Struktura krystaliczna w ceramice
Utworzenie stałego układu nie jest zawsze możliwe. Stosunek promieni anionu i kationu nie może być za mały, bo kation byłby przesuwany w
kierunku jednego jonu – anionu
wielkość K
+
A
-
r
kationu
< r
anionu
.
Podstawowe układy krystalograficzne
Wady budowy krystalicznej ceramiki
Materiały ceramiczne zawierają jony dwóch typów, dlatego wakanse i jony międzywęzłowe mogą występować w postaci kationowej lub
anionowej.

Przykładowe struktury krystaliczne
Struktura B1- typ chlorku sodu NaCl – układ regularny można rozpatrywać jako zwarty układ anionów, w którym wszystkie luki oktaedryczne
są zajęte przez kationy. Ceramiki wykazujące ten typ struktury: MgO, CaO, FeO, NiO.
Struktura B2 – typ chlorku cezu CsCl układ regularny, w komórce dwa jony. Ceramiki wykazujące ten typ struktury: CsBr, TlCl, TlBr.
Struktura B3 – typ sfalerytu (blendy cynkowej ZnS) – układ regularny, brak środka symetrii! Można rozpatrywać jako strukturę A1
zbudowaną z atomów S, w której połowa luk tetraedrycznych jest wypełniona atomami Zn. Wiązanie ma charakter kowalencyjny Zn-S~87%.
Ceramiki wykazujące ten typ struktury: typowe dla półprzewodników: CdS, HgTe, NiAs, Sic, GaAs.
Struktura korundu Al
2
O
3
- układ HZ (sieć heksagonalna zwarta). Każdy jon w sieci ma 1 lukę oktaedryczną i 2 oktaedryczne. Można
rozpatrywać jako sieć jonów tlenu z jonami glinu, w 2/3 wypełniających luki oktaedryczne, z 1/3 pozycji pustych. Ceramiki wykazujące ten
typ struktury: Cr
2
O
3
, Fe
2
O
3
, Al
2
O
3.
Wykład 6: Ceramiczne roztwory stałe szkła.
Struktura spinelu i odwrotnego spinelu
Spinele – AB
2
O
4
– układ typowy dla tlenków, struktura FCC (r
A
>r
B
)
W niektórych spinelach jony A wymieniają się miejscami z połową jonów B, powstaje spinel inwersyjny (odwrotny):B(A
0.5
B
0.5
)
2
O
4
- jony A i
½ jonów B zajmuje luki oktaedryczne, ilość jonów w lukach A=B.
Struktura typu perowskitu
Syntetyczne perowskity mono- lub polikrystaliczne można podzielić na:
- proste związki (podwójne tlenki): ABX
3
, gdzie: A - to 24 atomy różnych pierwiastków, w tym: Ba, Ca, Pb i pierwiastki ziem rzadkich , B –
to 50 atomów różnych pierwiastków, w tym Ti, Zr, Nb, Sn i niemetale grupy halogenów.
- wieloskładnikowe roztwory stałe
Reguły Hume Rothery’ego dla ceramik
Zasady tworzenia ceramicznych roztworów stałych:
1) Ta sama struktura krystaliczna
2) Atomy lub jony muszą mieć podobne wielkości promieni – różnica poniżej 30% (w przypadku różnic powyżej 15% ograniczona
rozpuszczalność składników (poniżej 1%))
3) Musza posiadać podobne elektroujemności
4) Muszą mieć tę samą walencyjność
Jeżeli wszystkie warunki są spełnione = niekoniecznie całkowita rozpuszczalność!!!
Jeśli 1 lub więcej warunków nie jest spełniony = częściowa rozpuszczalność!!!
Przykładowe struktury krzemianów
Jeżeli krzemionka tworzy związek z tlenkami metali jak MgO, CaO lub Al
2
O
3
, gdzie MO/SiO
2
=2:1 (lub jest większy), to krzemian zbudowany
jest z monomerów SiO
4
połączonych cząsteczkami MO. Jeżeli stosunek MO/SiO
2
< 2:1 powstają dimery krzemionki, połączone mostkami
tlenowymi. Dzięki tej polimeryzacji powstają struktury łańcuchowe, warstwowe i szkieletowe.
Krzemiany trójwymiarowe
Krzemionka – SiO
2
:
- sześcienna krzemionka – struktura regularna diamentu z tetraedrami SiO
4
w położeniach atomu węgla
- posiada kilka odmian krystalicznych:
Kwarc
----- kwarc
--- trydymit
------ krystobalit
--- stopienie
Skalenie – wykazuje podobną strukturę do krzemionki, w której jony Al
3+
zastępują Si
4+
, stąd sieć krystaliczna ma ładunek (
-
) kompensacja
ładunku przez podstawienia kationów o dużej objętości (Na
+
, K
+
, Ca
2+
, Ba
2+ )
w pozycjach międzywęzłowych.
Definicja szkła
- materiał nieorganiczny powstały w skutek stopienia, a następnie ochłodzenia bez krystalizacji,
- spełnia makroskopową definicję ciała stałego, chociaż może być też uważane za przechłodzoną ciecz,
- nie jest plastyczne: może być odkształcone sprężyście lub pęknąć.
T
g
– temperatura przejścia do fazy szklistej „temperatura zeszklenia” jest to temp., w której ciało amorficzne wykazuje zmianę nac hylenia
zależności objętości właściwej od temperatury.
Skład chemiczny szkieł
Głównym składnikiem szkła (zwykłego) jest SiO
2
Inne składniki szkieł – pierwiastki szkłotwórcze, które w związkach z tlenem tworzą sieć wielościanów, np.: Si, B, P, Ge, mają liczbę
koordynacyjną 3 lub 4. Szkło tworzą również inne tlenki, jak Bi
2
O
3
, CuO, PbO.
Skład szkła (tlenkowego) – oprócz pierwiastków szkłotwórczych zawiera najczęściej jeszcze inne pierwiastki
- modyfikatory – przerywają sieć wielościanów, np. Na, Ca, Ba, K
- stabilizatory sieci : ani nie tworzą, ani nie przerywają sieci, np. Al., Li, Zn, Mg, Pb.
Struktura szkła krzemowego:
- Elementem podstawowym szkła kwarcowego (podobnie jak krystalicznego kwarcu) jest czworościan SiO
4
4-
- Liczba koordynacyjna krzemu wynosi 4
- Czworościany są ze sobą połączone narożami
Struktura szkła (tlenkowego)
Wg Zachariesen’a szkło zbudowane jak „ciągła przypadkowa sieć”, której atomy są rozłożone tak jak w cieczy. Układ musi spełniać
zazwyczaj następujące 4 warunki:
1) Atom tlenu może być połączony z najwyżej dwoma innymi atomami
2) Liczba koordynacyjna innych atomów jest zazwyczaj mała (≤4)
3) Wielościany koordynacyjne Si-O (lub inne) połączone są między sobą narożami
4) Wielościany tworzą trójwymiarową strukturę (ciągłą).
Właściwości szkieł
Mechaniczne:
- szkło ma bardzo duży moduł Young’a
- główną wadą szkła jest jego kruchość (zależy od jakości powierzchni)
Przyczyny kruchości szkła:
- główna – mikropęknięcia na powierzchni, które przemieszczają się najpierw powoli, a następnie katastrofalnie szybko
- pośrednie – para wodna i woda dostając się do mikropęknięć przyspiesza ich propagacje (przyspiesza zrywanie wiązań kowalencyjnych)
(Nie)jednorodność szkieł
W odpowiednich warunkach technologicznych (wygrzewanie, oświetlenie) w strukturze szkła mogą powstawać lokalne niejednorodności. Np.
klastry srebra (szkło fotochromatyczne), klastry złota (czerwone szkło z Murano).
Szkło fluoryzujące – dowolne szkło zawierające uran
Szkło opalizujące – w trakcie procesu chłodzenia powstaje w miejscach, gdzie warstwa szkła jest gruba, co zachodzi powoli, dzięki czemu
zachodzi krystalizacja i szkło staje się matowe.
Szkło w bąbelki:
- bąbelki powstają przez dodanie do stopionego szkła związków chemicznych, które reagując wytwarzają bąble,
- pojedyncze bąble można wprowadzać za pomocą szpikulca.
Rodzaje szkieł
Tworzywa szklano-ceramiczne:
- dodanie zarodków krystalizacji, takich jak: Ag lub TiO
2
powoduje, że krystalizowane szkło jest bardzo wytrzymałe i odporne na wysoką
temperaturę
- stosuje się w naczyniach kuchennych, konwerterach katalitycznych.
Wykład 7: Szkła, Cd
Wtórne właściwości szkieł:
Rozpuszczając dowolny pierwiastek lub tlenek w strukturze szkła kształtuje się właściwości wtórne. Substancje tego typu nazywa się
modyfikatorami i związkami (kationami) międzywęzłowymi (międzywięźbowymi). Stosuje się ok.35 pierwiastków, przy czym zmiana
zawartości już o 1% zmienia właściwości szkła.
Modyfikatory – zrywają wiązania w mostkach tlenowych, co zmniejsza lepkość, obniża temp. Mięknięcia oraz pogarsza właściwości, np.:
tlenki sodu, potasu, baru, strontu, magnezu i wapnia.
Związkami międzywięźdźbowymi są tlenki glinu, sodu, tytanu, żelaza, ołowiu, berylu, kobaltu.
Duże jony metalu nie przyłączają się do sieci przestrzennej, tylko są utrzymywane w pozycjach międzywęzłowych wiązaniami
jonowymi!!!
Właściwości optyczne – pochłanianie podczerwieni uzyskuje się przez wprowadzenie kompleksu międzywęzłowego opartego na tlenkach
żelaza różnej wartościowości (hutnictwo, spawalnictwo, lecznictwo, transport, nauka)
Odporność chemiczna szkła-wzrasta dzięki udziałowi Ba,Ca,Pb,Mg,Zn,Al.,Zr.
Szkło jest świetnym izolatorem. Wprowadzenie tlenków V
2
O
5
, Fe
3
O
4
, CoO, MnO, TiO
2
wywołuje właściwości półprzewodnikowe!
Szkła kwarcowe, porowate typu VYCOR stanowią gąbczasty szkielet zbudowany co najmniej w 96% z SiO
2
, a występujący w nich system
kanalików znacznie rozwija ich powierzchnię właściwą. Zastosowanie: jako błony półprzepuszczalne do rodziału mieszanin ciekłych i
gazowych, jako nośniki katalizatorów w procesach petrochemicznych, w biochemii do zastosowań klinicznych i diagnostycznych, do
eliminacji zanieczyszczeń (gł. węglowodorowych jak paliwa, nafty) z wód podziemnych i powierzchniowych.
SZKŁO PIANKOWE-otrzymuje się przez spienienie ciekłej masy szklanej środkiem gazo twórczym, np. pyłem węglowym, kredą,
wapieniem CaCO
3
; jest nieprzeźroczyste, odporne na korozje biologiczną i chemiczna, niepalne (nie wydziela gazów toksycznych).
Produkowane w 2 odmianach:
- czarne – struktura o zamkniętych porach
- białe – struktura o porach otwartych.
Szkło czarne posiada lepsze parametry izolacyjne i mniejszą nasiąkliwość niż białe, które z kolei cechuje większa wytrzymałośc na obciążenia
mechaniczne. Zastosowanie:
W budownictwie do izolacji termicznych i akustycznych (fundamentów, ścian, stropów i stropodachów), czasem jako samodzielną ścianę
działową, nawet jak przegrodę ogniową.
Wzmacnianie szkła
Wzmacnianie szkła polega na poprawieniu jakości powierzchni i takiej jej modyfikacji, że pęknieć albo nie ma, albo nie mogą się
przemieszczać.
- harowanie – powoduje lepsze właściwości mechaniczne dzięki naprężeniom wewnętrznym – zewnętrzna powierzchnia zostaje ściśnięta,
zewnętrzna rozciągnięta.
- chemiczna modyfikacja powierzchni – wymiana jonów Na
+
na K
+
na powierzchni.
Szkło umieszcza się w stopionej soli zawierającej jony K
+
. Większe jony K+ rozpychają zewnętrzną powierzchnię. Dyfuzja powoduje
wymianę jonów sodu na jony potasu. Obie metody hartowania prowadzą do 2-4-krotnego wytrzymałości szkła.
- nanoszenie warstw, laminowanie szkła
Kolor szkła
- jest efektem obecności zdyspergowanych jonów metali w postaci klasterów
- zależy też od wielkości klasterów metalu, a ich wielkości związane są z obróbką chemiczna i termiczną szkła
- zależny jest od procesów utleniania, redukcji lub dyfuzji zachodzących pod wpływem światła i innych czynników.
Źródłem koloru wywołanego obecnością nanoklastrów metalu są powierzchniowe plazmony. (Plazmon to kwazicząstka powstała w wyniku
kwantyzacji drgań częstości ładunku, inaczej rezonansowe drgania gazu elektronowego).
Kolor szkła a właściwości optyczne
W celu zapewnienia skutecznej ochrony słonecznej, wśród szkieł zespolonych znalazły zastosowanie szkła refleksyjne typu float różnej
barwie i grubości pokryte warstwą refleksyjną, umożliwiające zwiększenie odbicia promieni słonecznych. Promieniowanie słoneczne
napotykając na przegrodę szklaną zastaje po części odbite, pochłonięte w grubości szkła oraz przepuszczone do wnętrza pomieszczenia. Szkła
barwione w masie charakteryzujące się podwyższonymi parametrami absorpcji (możliwość kumulacji w masie szkła).
Włókna szklane
Włókna chemiczne, otrzymywane ze szkła wodnego lub ze stopionego szkła:
- włókna szklane grube (tzw. wata szklana lub wełna szklana), stosowanie gł. Jako izolacja cieplna, akustyczna, przeciw wilgoci,
- włókna supercienkie są stosowane do wyrobu dobrych izolacji akustycznych i cieplnych
- włókna szklane ciągłe stosowane w postaci przędzy, wyrobów tkanych i dzianych oraz robingu (zespół pasm włókien szklanych złączonych
ze sobą bez skrętu) jako materiał izolacyjnych w elektrotechnice, do wyrobów filców, tkanin dekoracyjnych, do wzmacniania tworzyw
sztucznych, do zbrojenia betonu.
- włókna szklane jako mata, w rolkach używane do produkcji różnych wyrobów w formach silikonowych i formach twardych z użyciem
żywicy poliestrowej
- włókna optyczne – cienkie i giętkie włókno zdolne do przewodzenia światła, składa się z bardzo cienkiego rdzenia otoczonego
koncentrycznymi warstwami szkła i innych materiałów.
Włókna specjalne
Światłowód – przeźroczyste włókno szklane (lub wykonane z tworzywa sztucznego), w którym odbywa się propagacja światła przenosząca
promieniowanie optyczne drogą wielokrotnych odbić. Światłowód zbudowany jest z co najmniej 2 warstw, bo całkowite wewnętrzne odbicie
następuje, gdy światło przechodzi z ośrodka o większym współczynniku załamania do ośrodka o współczynniku mniejszym. Powłoka
ochronna, np. ze szkła sodowego ogranicza niekontrolowanego wypływu szkieł tworzących rdzeń i płaszcz włókna, co pozwala na
uformowanie światłowodu.
Szkło metaliczne
Stop amorficzny dwu- lub wieloskładnikowy, w którym metal jest głównym składnikiem (np. Zr,Ti,Cu,Ni,Be) zbudowany z atomów znacznie
różniących się między sobą, co zmniejsza tendencję do krystalizacji i otrzymany przez bardzo szybkie chłodzenie. Taki materiał cechuje duża
twardość, sprężystość, odporność na korozję oraz duży opór elektryczny. Jednak zwykle jest kruche, a nawet bardzo małe pęknięcie bez
przeszkód się pogłębia. Dlatego ze szkła robi się tylko części nienarażone na silne uderzenia, np. odporne na ścieranie głowice magnetyczne.
Jest to materiał magnetyczny miękki – łatwo można go rozmagnesować niewielką ilością prądu (zastosowanie w sklepach w postaci pasków
zabezpieczających odzież przed kradzieżą). Współcześnie szkło metaliczne jest mikrostopem zawierającym pallat dzięki czemu nie jest
kruche, ale plastyczne (zwykle im bardzien twardy jest materiał, tym bardziej kruchy). Pozostałe jego składniki to fosfor, krzem, german i
srebro. Choć bardzo twarde pod obciążeniem, które doprowadziłoby do pęknięcia najtwardszej stali, szkło się tylko wygina. Jest wyjątkowo
wydajne jeżeli chodzi o właściwośći sprężyste. Oddaje do 97% energii, która się przyłoży. Zastosowania – zwłaszcza w sporcie, np. w
rakietach tenisowych i kijach golfowych. Nadaje się tez do produkcji narzędzi chirurgicznych, ponieważ jego powierzchnia jest idealnie
gładka, co sprawia, że bardzo łatwo jest poddać je procesowi sterylizacji. Dzięki wyjątkowej trwałości można by z niego wyprodukować
maszynki do golenia, które wystarczyłyby na całe życie.
Szkło organiczne
Szkło akrylowe – przeźroczyste tworzywo sztuczne, którego GL. Składnikiem jest polimer – Poli (metakrylan metylu) (PMMA). Niektóre
rodzaje pleksiglasu zawierają też pewne ilości innych polimerów i kopolimerów poliakrylowych.
WYKŁAD 8: Polimery Tworzywa sztuczne
Polimery - substancje chemiczne, o bardzo dużej masie cząsteczkowej, nazywane również związkami wielocząsteczkowymi, a ich cząsteczki
makrocząsteczkami, które składają się z wielokrotnie powtórzonych mniejszych jednostek zwanych merami.
Są materiałami organicznymi tj. kowalencyjnymi związkami węgla. Oprócz C w polimerach występują także pierwiastki takie jak : H, Cl, O,
F, P i S, tworzą one z węglem wiązania kowalencyjne o pewnym stopniu polarności.
Tworzywa sztuczne- materiały które oprócz polimeru, zawierają także dodatki, np. napełniacze, zmiękczacze, stabilizatory, środki smarujące
lub środki barwiące.
Polimery naturalne są jednym z podstawowych budulców organizmów żywych.
Polimery syntetyczne-podstawowy budulec tworzyw sztucznych, a także wielu innych powszechnie wykorzystywanych produktów
chemicznych takich jak: farby, kleje, oleje przemysłowe, środki smarujące, kleje itp. Otrzymuje się je w wyniku łańcuchowych lub
sekwencyjnych reakcji polimeryzacji ze związków posiadających minimum dwie grupy funkcyjne.
Polimeryzacja- proces łączenia się związków małocząsteczkowych w makrocząsteczkach, może zachodzić przez addycję (dodawanie) lub
kondensację
Zalety:
Łatwa obróbka, duża plastyczność, lekkość produktów, izolacja termiczna, izolacja elektryczna, odporność korozyjna
zastosowanie produkty o zwiększonym zużyciu, plastiki i materiały opakowaniowe, przemysł samochodowy, lotniczy, kosmiczny,
konstrukcje, izolacje przewodów, rury, skrzynie, pudełka, powłoki
Typowe polimery:
Polietylen PE (plastik), polipropylen PP (plastik, włókna), Polistyren PS (styropian-pianka PS), polifluorek winylidenu PVDF, polimetakrylan
metylu PMMA
Klasyfikacja polimerów ze względu na pochodzenie
Polimery
Nieorganiczne
organiczne
Naturalne
syntetyczne
naturalne
syntetyczne
Glina, skały
włókno szklane białka, lignina
nylon,
Piasek, ceramika Sic, synt. ceramika
węglowodany
polistyren
Szkło, diament
bawełna, nić pajęcza
PCW, POW,
Grafit
kauczuk naturalny
PET, keflar, Poliuretan
Polimeryzacja addycyjna
Typowa dla węglowodorów nasyconych
Zachodzi dzięki obecności wiązania podwójnego
Proces musi zostać w jakiś sposób zainicjowany oraz zakończony
Reakcja zachodzi szybko ze względu na ograniczenie ilością monomerów i bez produktów ubocznych
Typowa dla PE, PMMA, PCV, PP, PS, PTFE
Polikondensacja
Seria reakcji chem. Wielokrotnie powtórzona dla wzrostu polimeru
Przebiega stosunkowo wolno, pomiędzy monomerami posiadającymi przynajmniej dwie grupy funkcyjne
Powstają niskocząsteczkowe produkty uboczne
Tak powstają m.in. poliuretan, polistyren, epoksydy, silikony
Właściwości polimerów
Mała gęstość
Właściwości izolacyjne
Słabe odbicie światła
Duża odporność chemiczna
Ograniczona możliwość poddawania obróbce cieplnej i plastycznej
Czynniki wpływające
Masa molowa-łańcuchy nie mają równej długości
Siła oddziaływań między cząsteczkami
Podatność łańcucha na wyginanie
Struktura: stopień krystaliczności, rozgałęzienia, usieciowanie
Temperatura
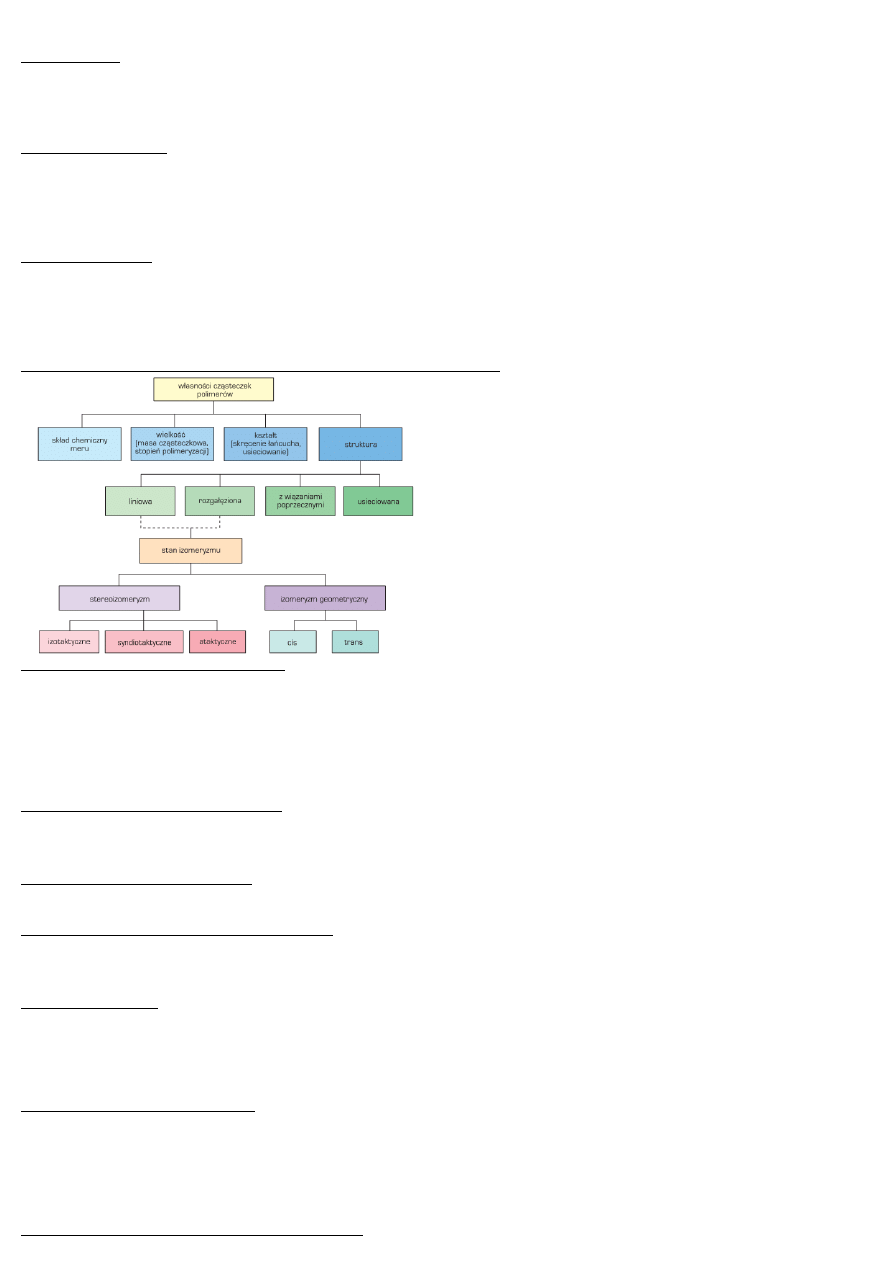
Klasyfikacja polimerów w zależności od budowy (własności ) makrocząsteczek
Klasyfikacja polimerów – skład chemiczny:
homopolimer
kopolimer
o statystyczny
o blokowy
o naprzemienny
o szczepiony
terrpolimer
Klasyfikacja polimerów –budowa łańcucha
liniowe
rozgałęzione (gwiazdy, grzebienie, szczotki, hiperrozgałęzienia)
usieciowione
Oddziaływania między cząsteczkami :
Wewnątrz łańcucha: siły kowalencyjne
Pomiędzy łańcuchami: wodorowe, Van der Vaalsa
Klasyfikacja polimerów –budowa stereochemiczna:
izotaktyczny
syndiotaktyczny
ataktyczny
Morfologia polimerów
W wielu polimerach łańcuchy ułożone są przypadkowo a nie wg. regularnego trójwymiarowego wzoru są więc niekrystaliczne czyli
amorficzne
Morfologia polimeru= stan uporządkowania w fazie stałej
Gdy łańcuchy polimeru układają się jeden na drugich ich powtarzalność prowadzi do stanu krystalicznego zwykle określanego jako
częściowokrystaliczny lub semikrystaliczny.
Struktury nadcząsteczkowe polimerów
Struktura polimerów jest najczęściej amorficzna, ale może być też krystaliczna- powstają stany uporządkowania cząsteczkowego
Faza Amorficzna- skłębione struktury bezpostaciowe; brak uporządkowania dalekiego zasięgu
Faza krystaliczna- uporządkowanie dalekiego zasięgu; giętkie łańcuchy→ płytkowa struktura lamelarna; sztywne
czasteczki→micele(celuloza)
Faza mezomorficzna- struktura mezofazowa (pośrednia); sztywne pałeczkowe makrocząsteczki; anizotropowe zbiory mezogenów
ułożonych równolegle→ struktura mezofazy aż do cieczy; polimery ciekłokrystaliczne
Czynniki wpływające na stopień krystalizacji polimerów

Ilość rozgałęzień łańcucha- im więcej tym mniejsza tendencja do krystalizacji
Wielkość i asymetria grup bocznych
Długość łańcucha
Szybkość chłodzenia
Odkształcenie łańcuchów i inne sposoby wymuszania kierunku wzrostu w czasie chłodzenia
Struktura a właściwości polimerów
AMORFICZNE
KRYSTALICZNE
Mikrostruktura
Łańcuchy nieuporządkowane w fazie stałej i w stopie
.
Łańcuchy nieuporządkowane w stopie, natomiast w fazie stałej silnie
uporządkowane
Reakcja na ciepło
Miękną w szerokim przedziale temp. (brak ostrej temp. topnienia)
.
Ostra temp. topnienia
Podstawowe cechy
Przeźroczyste
Słaba odporność chem.
Mały skurcz objętościowy po wtrysku/wytłaczaniu
Zwkle mała wytrzymałość mechaniczna
Wysoka lepkość stopu
Małe efekty termiczne przejść fazowych
.
Prześwitujące/mętne
Świetna odporność na chemikalia
Duży skurcz objętościowy po wtrysku/wytłaczaniu
Zwykle duża wytrzymałość mechaniczna
Niska lepkość stopu
Wysokie efekty termiczne przejść fazowych (ciepło krystalizacji)
Temperatura zeszklenia- T
g
temp. w której następuje przejście ciała bezpostaciowego(amorficznego )ze stanu szklistego do elastycznego lub
odwrotnie. Chociaż temp. zeszklenia jest najważniejsza wielkością char. ciało amorficzne nie ma ona dla danej substancji stałego poziomu-
zależy bowiem od szybkości z jaką zachodzi zmiana temperatury.
Temperatura a twardość polimerów
Niektóre polimery w podwyższonej temperaturze stają się twardsze (polimery termoutwardzalne). Utwardzanie wynika z powstawania
wiązań między łańcuchami (usieciowanie).W następstwie:
Nie można ich już przerabiać, topić itp.
Są sztywniejsze, twardsze i termicznie bardziej odporne niż termoplastyczne
Są to np żywice epoksydowe, aminowe, poliestry, poliuretany, silikony
Niektóre polimery powyżej temp. Zeszklenia są plastyczne i można je kształtować jak plastelinę (polimery termoplastyczne) m.in.:
akryle(pleksi), teflon, nylon, poliwęglan, poliestry, polietylen
Klasyfikacja polimerów-właściwości reologiczne
Polimery
Elastomery- wykazują skłonność do dużych odkształceń sprężystych
o
wulkanizujące
o
niewulkanizujące
Plastomery- polimery o wydłużeniu przy rozerwaniu do 200%
o Termoplasty-grupa tworzyw które pod wpływem ogrzewania topnieją i przechodzą w stan ciekły(co ułatwia ich formowanie), a
następnie po ochłodzeniu przechodzą w stan stały(proces odwracalny). Tworzywa termoplastyczne nadają się do wielokrotnego
przetwórstwa.
bezpostaciowe
krystaliczne
o Duroplasty- grupa tworzyw które pod wpływem temp. Lub związku chemicznego tworzą trwałe wewnętrzne wiązania- przechodząc
jednocześnie w stan stały
chemoutwardzalne
termoutwardzalne
Wyprostowanie oraz uszeregowanie (orientacja) makrocząsteczek powoduje wzrost wytrzymałości polimeru
Stany fizyczne polimerów: Zachowanie się polimerów pod obciążeniem zależy od:
Budowy makrocząsteczki, stan uporządkowania cząsteczkowego(struktura)
temperatury i skali czasu pomiaru
duży wpływ ma gęstość usieciowania polimeru(ilość wiązań poprzecznych)
Polimery występują w stanie:
o Gumy (elastomery)
o Szklistym
o
Krystalicznym lub częściowo krystalicznym
Niektóre polimery w ogóle nie występują we wszystkich fazach
Masa cząsteczkowa a właściwości polimerów:
Wszystkie polimery mogą mieć tę samą średnią liczbową masę cząsteczkową. Największy wpływ masa cząsteczkowa wywiera na :
o
Własności kinematyczne
o
Przeźroczystość
o
Topliwość
o
Udarność
Przetwórstwo polimerów
Polimery rzadko znajdują zastosowanie w stanie czystym. Metody zależą od rodzaju przetwarzanego materiału. Najważniejsze:
wtryskiwanie
Prasowanie, prasowanie tłoczne
Odlewanie odśrodkowe
Wytłaczanie i wytłaczanie z rozdmuchem
Formowanie na gorąco
Kalandrowanie

Formowanie próżniowe
Przędzenie
Spienianie
Laminowanie
Zastosowanie polimerów
Aeronautyka (odporność na wys. temp i utlenianie)
Budownictwo(zastępują metal)
Włókna(światłowody, ciekłe kryształy, kord w oponach)
Polimery niepalne(meble, budownictwo, komunikacja)
Polimery degradowalne (mała ilość odpadów, kontrolowane dozowanie leków, pestycydy, nawozy)
Medycyna(nici chirurgiczne, sztuczne organy)
Elektronika(płyty komputerowe, izolatory, ogniwa)
Wykład 9 i 10: Kompozyty-projektowanie, właściwości, otrzymywanie
Kompozyty a podstawowe klasy materiałów:
Kompozyt ceramika- metal- polimer
Kompozyt ceramika-metal
Kompozyt ceramika-polimer
Własności kompozytu musza być:
Wyższe, inne, dodatkowe w stosunku do własności każdej z użytych faz osobno lub zmieszanych razem
Zależne od udziału poszczególnych faz
Kompozyt - materiał utworzony z co najmniej dwóch komponentów (faz) o różnych właściwościach w taki sposób że ma właściwości lepsze i
(lub) właściwości nowe (dodatkowe)w stosunku do komponentów użytych osobno lub wynikających z prostego sumowania tych własności-
kompozyt jest materiałem zewnętrznie monolitycznym, jednakże z widocznymi granicami miedzy komponentami
Klasyfikacja kompozytów
Kompozyty naturalne: powstałe na drodze ewolucji przyrody, tam gdzie warunkiem istnienia było przenoszenie dużych obciążeń np.
kości zwierząt, ptaków oraz człowieka, ścięgna, mięśnie.
Drewno (kompozyt wzmacniany włóknami celulozy w ligninie i hemicelulozie), jajko, trawa, bambus, łodygi roślin i gałęzie.
Kompozyty sztuczne - wytwarzane przez człowieka np. suszona na słońcu gliniana cegła wzmacniana słomą i końskim włosiem, asfalt
naturalny wzmacniany słomą, końskim włosiem i tkaninami,
Tworzenie materiałów kompozytowych wykazujących podwyższenie własności mechanicznych jak:
Sztywność
Wytrzymałość
Odporność na pękanie i ścieranie
Lub w celu:
Obniżenia ciężaru/kosztów wytwarzania
Zmniejszenia modułu sprężystości
Zmiany przewodności cieplnej i elektrycznej
Zmiany współczynnika rozszerzalności cieplnej
Budowa kompozytów
Osnowa-faza ciągła i otaczająca cząstki innej fazy nazywanej umacniającą
Zbrojenie-faza umacniająca o różnej geometrii i względnej ilości, otoczona osnową
Połączenie między osnową i zbrojeniem stanowi niezwykle ważny czynnik :
im silniejsze wiązanie pomiędzy dwiema fazami tym lepiej
wiązanie może być pośrednie(może zajść konieczność dodania trzeciego składnika, a może to być jedna faza rozpuszczona w
drugiej) oraz bezpośrednie
powstaje trzecia faza pomiędzy matrycą a elementem zbrojenia, która ma duże znaczenie dla trwałości
Osnowa ma za zadanie
zlepiać i wiązać zbrojenie oraz zatrzymywać rozprzestrzenianie się pęknięć
Zabezpieczać zbrojenie przed mechanicznym uszkodzeniem
Przenosić naprężenie zewnętrzne na zbrojenie
Decydować o właściwościach chemicznych i cieplnych kompozytu
Nadawać wyrobom żądany kształt
Klasyfikacja kompozytów z względu na materiał osnowy:
metalowej
międzymetalicznej
ceramicznej
organicznej:
o
węglowej
o polimerowej
Podział ze względu na materiał zbrojenia:
1. komp wzmacniane cząstkami
duże cząstki,
utwardzane dyspersyjnie
2. komp wzmacniane włóknami
tkaniny
włókna ciągłe,
włókna nieciągłe:
o zorientowane,
o rozmieszczone przypadkowo
3. komp strukturalne:
kompozyty o osnowie
warstwowe,
z rdzeniem z materiałów lekkich
Zbrojenie
może mieć postać proszku lub włókien
Dodawane jest w dużej ilości do kompozytu
Zwykle tylko fizycznie oddziałuje na osnowę
Zadanie - wzmacnianie materiału oraz poprawienie jego określonych właściwości mechanicznych (lub użytkowych)
właściwości kompozytu zależą ściśle od cech geometrycznych zbrojenia
Optymalne właściwości można uzyskać je jeżeli cząstki zbrojenia:
maja jednakowe rozmiary i kształty;
są równomiernie rozłożone i zorientowane
Zawartość procentowa zbrojenia zajętej objętości zależy od późniejszego zastosowania kompozytu.
Klasyfikacja ze względu na geometrie zbrojenia:
a) cząstki o rożnym stopniu dyspersji
b) płatki (różna wielkość i materiały)(płytki szklane, talk, mika)
c) włókna nieciągłe(szklane, węglowe)
d) włókna ciągłe(jednokierunkowe, tkaniny, maty)(szklane, węglowe, aramidowe)
e) szkieletowo(w konstrukcjach typu „sandwich”)
f) warstwowo w laminatach
Komp typu ceramika- polimer
Polimery stosowane jako osnowa spełniają istotne funkcje:
umożliwiają przenoszenie obciążeń na włókna
nadają wyrobom pożądany kształt
decydują o właściwościach cieplnych i chemicznych oraz o palności kompozytów
wywierają istotny wpływ na metody wytwarzania kompozytów
Kompozyty polimerowe- materiał zbrojenia
stosowane cząstki wzmacniające tzw. „napełniacze”:
o
napełniacze mineralne-najczęściej ziarna lub kulki
zmielona kreda, kamień wapienny, marmur, strącany węgiel wapnia
mączka kwarcowa, kaolin, skaleń, wodorotlenek glinu, krzemionka
o
napełniacze kuliste(poprawiają płyniecie tłoczyw, zmniejszają skurcz, zwiększają trwałość kształtu)
pełne kulki szklane- poprawiają twardość, wytrzymałość na rozciąganie
puste kulki popiołów lotnych-duża odporność na ściskanie, zmniejszenie masy wyrobu
włókna wzmacniające nieciągłe
rozdrobnione włókna drzewne
krajanka włókien na bazie celulozy, sizalu, juty
włókna szklane, coraz częściej węglowe
włókna polimerowe: PAN, PET, PCV
włókna wzmacniające ciągłe
włókna szklane(tkaniny, izotropowe maty)- niskoalkaiczne, wysokowytrzymałe
włókna węglowe(rowing, tkaniny)
włókna aramidowe (Kewlar) - rowing, tkaniny
mieszanki włókien(szklane-węglowe, szklane-aramidowe, węglowe-aramidowe)
włókna polimerowe(PAN, PET, PCV, PA6, PA66)
kompozyty węglowe
Włókna karbonizowane-otrzymywane w wyniku pirolizy włókien chemicznych wiskozowych lub poliakrylonitrylowych; rozróżnia się dwa
rodzaje włókien karbonizowanych:
1. włókna węglowe, zaw. 90-96% węgla pierwiastkowego, o nie w pełni zorientowanej strukturze kryształów,
2. włókna grafitowe, o zawartości > 96%(często blisko 99%) węgla o krystalicznej, zorientowanej strukturze, postają z włókien
węglowych podczas ich ogrzewania w temp. > 2500ºC
Materiały stosowane na osnowę i wzmocnienie kompozytów

Włókno- ciało o dużej „smukłości”, którego długość jest znacznie większa od jego średnicy (1μm÷ ok 0,15mm), odznaczające się z reguły
anizotropią struktury a więc i właściwości.
Włókno to najczęściej stosowany rodzaj zbrojenia w kompozytach w postaci:
o
ciągłej(b. długiej ) lub nieciągłej(whiskery)
o
uporządkowanej lub nieuporządkowanej
Włókna stosowane do produkcji kompozytów można podzielić na:
włókna metalowe-molibdenowe, wolframowe, stalowe, berylowe
wł węglowe i grafitowe
wł tlenkowe- trójtlenek glinu, dwutlenek toru, dwutlenek cyrkonu
wł węglikowe-węglik krzemu, węglik tytanu, węglik cyrkonu
wł szklane
wł organiczne-kevlar, vectran
wł mineralne
Własności kompozytów
Czynniki wywierające wpływ na własności kompozytów związane z wprowadzeniem w czasie produkcji włókien do osnowy:
a) czynniki obniżające wytrzymałość włókien
1. reakcja z osnową lub pokryciem włókna
2. uszkodzenie powierzchniowe w czasie wytwarzania kompozytu
3. pęknięcie włókna na odcinki krótsze od długości krytycznej
b) czynniki obniżające wytrzymałość umocnienia z osnową
4. słabe związanie włókien z osnową
5. słabe związanie włókien z pokryciem
6. słabe związanie pokrycia z osnową
c) czynniki obniżające wytrzymałość osnowy
7. porowatość
8. obce wtrącenia
9.zanieczyszczenia segregujące na granicach ziaren osnowy lub na powierzchni rozdziału włókno-osnowa
d) czynniki strukturalne
10.niewłaściwa orientacja włókien
11.niski udział objętości włókien
12. niewłaściwe rozmieszczenie włókien
Właściwości włókien zależą od:
rodzaju materiału użytego do produkcji włókien
technologii wytwarzania włókien
długości i średnicy włókien
struktury i liczby defektów we włóknie
Cechy wiązania matryca(osnowa)-włókno:
zbyt słabe: włókna zostaną wyciągnięte z osnowy
zbyt silne: materiał zachowuje się jakby był jednolity, nie ma absorpcji energii mechanicznej na granicy matryca włókno
optymalne: najpierw pęka osnowa, później oddziela się od włókien, na koniec pękają włókna
Wytrzymałość kompozytu umacnianego włóknami rośnie w miarę wzrostu udziału objętościowego włókien. Aby osiągnąć efekt umocnienia,
udział objętościowy włókien musi przekroczyć tzw. Obj. Krytyczną i może dochodzić do 90%.
Wady kompozytów ( trudne do wykrycia i naprawienia):
mikropęknięcia
połączenia między włóknami a matrycą mogą ulec zniszczeniu
stopniowa degradacja matryc polimerowych
Właściwości mechaniczne kompozytu zależą od;
mechanicznych właściwości włókna
wielkości naprężenia, które jest przekazywane przez osnowę(zależy od siły wiązania między włóknem a osnową)

pewnej krytycznej długości włókna, poniżej której nieefektywnie wzmacnia ono kompozyt(zależy od średnicy włókna, wytrzymałości
na rozciąganie i siły związane z osnową, powierzchnia wiązania z osnową musi być wystarczająco duża)
Rodzaje splotów włókien w:
tkaninach:
a) płócienny
b) pięcionicielnicowy
c) jednokierunkowy
d) płócienny z krajką
oplotach:
e) trójosiowy oplot
Dla uzyskania dobrej jakości kompozytu należy spełnić najmniej trzy warunki:
1.
unikać uszkodzenia włókien
2.
zapewnić właściwe ich rozmieszczenie w osnowie zgodnie z projektem
3.
zapewnić odpowiednie wiązanie włókna z osnową
Metody poprawiające wiązanie włókna węglowego z osnową polimerową:
1.
utlenianie powierzchni włókien
2.
osadzanie na powierzchni włókien whiskerów innych substancji
3.
nanoszenie na powierzchnię włókien odpowiednich preparacji
Włókna polimerowe
Vectran- sztuczne włókno otrzymywane z ciekłokrystalicznego polimeru.
TYPY:
WŁAŚCIWOŚCI:
Vectran NT
(odporność na przecięcia, niska wytrzymałość na rozciąganie)
Vectran HT
(wysoka wytrzymałość, odporność na przecięcie)
Vectran UM
(duży moduł i wysoka wytrzymałość)
wys odporność na pełzanie oraz ścieranie
b.dobre właściwości dielektryczne
wys udarność
odporność na cięcie
niski skurcz termiczny
zdolność do tłumienia drgań
wys odporność chemiczna
trwałość w wys temperaturach(do 220ºC)
Zastosowanie:
Poduszka powietrzna sond marsjańskich
Deska windsevingowa,
Liny, sznury, kable, Żagle
Włókna węglowe – prekursory:
sztuczny jedwab
asfalty
smoły
fenol, imidy, amidy
Wytwarzanie włókna węglowe:
1. wygrzewanie w atmosferze powietrza (w temp. 200 – 300°C)
2. wygrzewanie w atmosferze obojętnej (w temp. 1000°C)
3. obróbka cieplna w atmosferze obojętnej w takiej temp., a by w wyniku odpowiedniego stopnia grafityzacji uzyskać pożądane
właściwości wł węglowego.
Włókna węglowe zastosowanie:
Sztuczne satelity, anteny, samoloty, wyroby elektroniczne, kable, łozyska.
Cechy włókien i kompozytów węglowych:
dobra biozgodność w środowisku tkanek
dobre właściwości fizykochemiczne
odporność na działanie promieniowania jonizującego i niejonizującego
implanty pokryte warstwą węglową sposobem wyeliminowania alergii kontaktowej na metale
Kompozyty z włókien węglowych zastosowania:
Implanty złamanego kręgosłupa, sprzęt sportowy,
Kompozyty konstrukcyjne
Kompozyty o osnowie polimerowej, wykazują wysokie parametry mechaniczne (zastosowanie w budowie maszyn, pojazdów, samolotów):
LAMINATY – dwuwymiarowe warstwy, różnie zorientowane względem siebie (równoległe/w różnych kierunkach), np. żywice
wzmacniane włóknami (tkaninami) szklanych, węglowymi lub aramidowymi
Budowa:
całość definiuje się podając sekwencję poszczególnych warstw, oddzielonych „/” (np. 45/0/-45)
kolejność warstw podaje się od góry do dołu
cała sekwencja umieszczona jest w nawiasach kwadratowych
mogą pojawić się subskrypty „s” (sekwencja warstw symetryczna względem środkowej płaszczyzny), „n”(n-krotne powtórzenie),
sekwencja symetryczna i składa się z nieparzystych ilości warstw ->warstwa środkowa ma w symbolu kreskę nad liczbą tej warstwy.
KOMPOZYTY WARSTWOWE (KANAPKOWE) – gdzie dwie silne warstwy zewnętrzne ozdzielone są warstwą słabszego i mniej
gęstego materiału (rdzeń). Najczęściej stosuje się kompozyty o osnowie polimerowej wzmacniane włóknami szklanymi, węglowymi lub
aramidowymi.
W zależności od przeznaczenia – zbrojenie w postaci przeróżnie splatanych tkanin, ciętych włókien, układów przestrzennych itp.
Kompozyty warstwowe o budowie komórkowej
Kompozyty komórkowe mają szereg niezwykłych właściwości np.: odporność na uderzenia, wytrzymałość mechaniczna przy ściskaniu,
przewodność cieplna
Układy komórek w rdzeniach o kształcie plastra miodu w materiałach kompozytowych warstwowych:

heksagonalny
h. wzmocniony
h. rozciągnięty
giętki
podwójny giętki
wydłużony
krzyżowy
Rolą rdzenia jest przeciwdziałać deformacjom spowodowanym działaniu siły prostopadłej do powierzchni zewnętrznych.
Wykład 11 i 12: Biomateriały
Biomateriał – każda substancja (ale nie lekarstwo), albo kombinacja substancji syntetycznych lub naturalnych, która może być użyta w
dowolnym okresie, a której zadaniem jest uzupełnienie lub zastąpienie tkanek, organów wewnętrznych albo jego części lub spełnienie ich
funkcji.
W organizmie ludzkim:
11 pierwiastków o podstawowym znaczeniu biologicznym: C, H, O, N, S, Ca, P, K, Na, Cl, Mg
15 pierwiastków śladowych: Fe, Zn, Cu, Mn, Ni, Co, Mo, Se, Cr, F, Sn, Si, V, As.
Ewolucja biomateriałów:
I generacja (od 1950) – materiały bioobojętne
II generacja (od 1980) – materiały bioaktywne
III generacja (od 2000) – materiały bioaktywne i zdolne do regeneracji tkanek:
o biokompatybilność
o silna, porowata struktura 3D
o nierozpuszczalny w wodzie, ale stopniowo biodegradowalny.
Biomateriały - podział:
1. Bioceramika
2. Tworzywa sztuczne
3. Tworzywa kompozytowe
4. Metale i ich stopy
obojętna
z kontrolowaną reaktywnością
tworzywa hydroksyapatytowe
materiały węglowe
materiały węglowe
polietylen
cementy resorbowalne
metaloporfiryny
żywice silikonowe
kompozyty C-C
kompozyty metal-ceramika
stale
stopy Co
Ti i jego stopy
Zastosowania biomateriałów:
wszczepy (implanty) biostatyczne, bioestetyczne i biomechaniczne,
materiały do zespalania tkanek (nici chirurgiczne, kleje do tkanek, cementy kostne),
wszczepy (implanty) przeznaczone do kontaktu z krążącą krwią,
sztuczne narządy i ich części,
błony półprzepuszczalne i inne części aparatury krążenia pozaustrojowego,
preparaty farmaceutycznie (nośniki leków),
inne (m.in. kontaktowe soczewki oczne).
Mogą być:
Dobór materiałów uwzględnia:
syntetyczne/naturalne
stan stały/ciecz
kompozytowe
samo-naprawiające się
biozgodność i biotolerancję (dla danego osobnika)
własności mechaniczne i wytrzymałościowe
stopień kontaktu z ciałem ludzkim (st. inwazyjności)
okres zastosowania
możliwości wykonawcze
ekonomiczność rozwiązania
Właściwości:
fizyczne: gęstość, lepkość, przewodność cieplna i elektryczna
mechaniczne: wytrzymałość, sprężystość, odporność zmęczeniowa
technologiczne: obrabialność, kształtowanie powierzchni
odporność korozyjna: biozgodność, biotolerancja
biologiczne:
o
biokompatybilność – nie może wywoływać reakcji obronnej tkanek,
o
neutralność dla organizmu – nie oddziałuje z tkankami,
o
bioaktywność – oddziałuje z tkankami (integracja),
o
biodegradowalność – materiał rozkłada się w organizmie, bez wydzielania toksyn.
Implanty (wszczepy) – wszelkie przyrządy medyczne wykonane z jednego lub więcej biomateriałów, które mogą być umieszczone wewnątrz
organizmu, jak również umieszczone częściowo lub całkowicie pod powierzchnią nabłonka, i które mogą pozostać przez dłuższy okres w
organizmie.
implant chirurgiczny – używany w kontekście umieszczenia go w zamierzonym miejscu w procedurze chirurgicznej (igły, dreny).
proteza implantowalna (proteza wewnętrzna/endoproteza) – przyrząd, który fizycznie zastępuje organ/tkankę. Bioproteza-proteza
wykonana w całości/częściowo z tkanek dawcy.
sztuczny organ – materiał medyczny, zastępuje w całości/częściowo funkcje jednego z głównych (chorych) organów ciała częściowo
w nieanatomiczny sposób.
Podział implantów (stężenia pierwiastków oddziaływają na zachodzenie różnych procesów życiowych):
krótkotrwałe – czas przebywania w środowisku tkankowym max 2 lata
długotrwałe – czas może znacznie przekroczyć 20 lat
Biomateriały metaliczne:
CELE
TYPY
METODY
NANOSZENIA
WYMAGANIA
biofunkcyjność
(odporność na ścieranie)
bariery dyfuzyjne
(podwyższenie
odporności na korozję)
poprawa osteointegracji
(ceramiczne warstwy
bioaktywne)
warstwy dyfuzyjne
związków tytanu
warstwy diamentowe
(NCD, DLC)
powłoki
hydroksyapatytowe
warstwy kompozytowe
metody wykorzystujące
plazmę, fotony, jony:
- procesy PDT
- RFCVD
-MWCVD
-PLD
metoda zol-żel
wysoka odporność na korozję
dobra jakość metalurgiczna i jednorodność
zgodność tkankowa (nietoksyczność)
odporność na zużycie ścierne
brak tendencji do tworzenia zakrzepów
odpowiednie własności elektryczne
odpowiednie własności wytrzymałościowe
Stopy na osnowie kobaltowej
Tytan i jego stopy
Stopy z pamięcią kształtu Aluminium i jego stopy
Właściwości
b. wysoka odporność na
korozję
własności zależne od
domieszek
mniejszy ciężar niż stopy
Fe lub Co
b. wysoka wytrzymałość
niewielki ciężar
łatwość formowania,
obróbki
niski koszt
wytworzenia
Zastosowanie
endoprotezy stawowe
płytki
wkręty
groty
druty
endoprotezy stawowe
elementy do zespalania
odłamków kości
protetyka
stomatologiczna
kardiochirurgia
ortodoncja
stabilizator (leczenie
skoliozy)
tulejki dystansowe
kręgosłupa
implanty krótkotrwałe
np. do konstrukcji
protez
Biomateriały ceramiczne:
Bioceramika
Obojętna
wysoka biotolerancja i wytrzymałość na ściskanie, ścieranie i zginanie
Al
2
O
3
(biokorund), węgle pirolityczne, (oksy)azotek krzemu, węglik krzemu, tlenki cyrkonu, tytanu
Resorbowalna
Małe koszty wytwarzania, biokompatybilność, zastąpienie ulegającego resorpcji implantu przez tkankę kostną
Hydroksyapatyt-materiał biologicznie aktywny, skład chem. i fazowy podobny do składu kości ludzkiej i zębów (->biotolerancja),
Bioaktywna
Kontrolowana reaktywność w organizmie, międzyfazowe połączenie implantu z tkanką kostną
bioszkło, hydroksyfluoroapatyt, wollastonit, kompozyty
Węglanowa
Na protezy ścięgien, wiązadeł, elementy zespalające kości
(Mikro)porowata
Wykazuje zdolność tworzenia naturalnego połączenia z tkanką kostną, mogą zawierać antybiotyki
Cementy kostne i stomatologiczne
Produkty dwuskładnikowe (proszek i płyn), z których po wymieszaniu powstaje mieszanina umieszczana następnie w miejscu
przeznaczenia
zespalanie materiałów z kością / ze sobą, wypełnianie przestrzeni ubytków kostnych, rekonstrukcja/odbudowa twardych tkanek zęba
Formy
Techniki
pokrywania
Zalety
Problemy
kształtki gęste
kształtki porowate
granule
proszek
pokrycia
ceramiczne na
implantach
metalicznych
plazma
elektroforeza
CVD, PVD
rozpylanie
jonowe
IBAD
osadzanie
elektrochemiczne
porowatość (umożliwia wrastanie się tkanki
okołowszczepowej i tworzenie trwałego
połączenia z implantem)
wysoka twardość, odporność na ścieranie i
wytrzymałość na ściskanie,
wysoka odporność korozyjna w środowisku
tkanek i płynów ustrojowych,
bdb biotolerancja - biozgodność chem. z
tkanką kostną
możliwość sterylizacji bez zmiany
właściwości materiału,
możliwość impregnacji lekami.
kruche, niska wytrz. na zginanie,
nieodkształcalne i nieodporne na
obciążenia dynamiczne,
za duża bioaktywność lub brak
biozgodności fizycznej z tkanką
kostną,
ujemny wpływ wydzielin (np. Al) z
implantów,
trudności w utrzymaniu
odpowiedniej wytrzymałości i
stabilności obszaru implantu z
tkanką żywą.
Biomateriały polimerowe:
SYNTETYCZNE
NATURALNE
Biostabilne
Biodegradowalne
Proteiny
Polisacharydy
polietylen
silikony
PLA
PGA
kolagen
soja
celuloza
kwas hialuronowy
Właściwości
Zastosowanie
łatwość uzyskiwania powtarzalnej jakości materiału dla
różnych jego partii,
łatwość formowania, pozwalająca na nadanie odpowiedniej
postaci użytkowej bez degradacji tworzywa ,
łatwość sterylizacji,
Resorbowalne podłoża polimerowe i kompozytowe dla sterowanej
regeneracji tkanek
Implanty konstrukcyjne o dopasowanych właściwościach
mechanicznych i kontrolowanym czasie resorpcji
Nośniki leków

odpowiednią jakość fizykochemiczną biomateriału,
brak odczynów toksycznych lub alergicznych
bioinertność
Materiały inteligentne
Biostabilne elementy zespalające, stabilizatory zewnętrzne
Materiały opatrunkowe –hydrożele, hydrokoloidy
Biomateriały jako nośniki leków
Nośniki leków
ceramiczne
(mikroporowate kapsuły) hydroksyapatyt,
TCP, bioszkła fosforanowe cementy kostne
polimerowe
(wiązanie chemiczne ulegające hydrolitycznemu
rozpadowi) polimery biodegradowalne
biologiczne
Kontrolowane uwalnianie leków, Optymalne dawki dla określonej terapii, Utrzymywanie odpowiednio wysokiego
miejscowego stężenia leku przez maksymalnie długi okres czasu, leki: antybiotyki, cytostatyki, hormony, leki
przeciwreumatyczne, przeciwrakowe
Biomateriały kompozytowe
Materiały hybrydowe organiczno-nieorganiczne
I. ceramika-polimer
II. węgiel – polimer
III. ceramika – węgiel
Wypełniacze ceramiczne (m.in. na bazie SiO
2
) odpowiadają za wł. fizykochemiczne materiału (zmniejszają kurczliwość, współczynnik
rozszerzalności termicznej i wchłanianie wody, podnoszą odporność na ścieranie, ucisk i rozciąganie).
Biomateriały zastępujące inne tkanki (dobór na zasadzie podobnej metody wzrostu tkanki na sztucznej matrycy):
1. Chrząstki: Tkana matryca polimerowa (kwas poliglikolowy), na której powstanie tkanka chrząstki
2.
Sztuczna
tkanka mięśnia serca na bazie
matrycy o strukturze plastra
miodu, składającą się jak
akordeon. Komórki tkanki
orientują się w
kierunkach
wyznaczonych przez
mikrostrukturę matrycy.
Polimerowa matryca zmusza komórki mięśniowe do
zorientowania się i
działania w odpowiednim
kierunku.
3. Biomateriały służące do regeneracji lub
zastąpienia neuronów są to kanały prowadzące nerwy oraz matryce z nanowłókien służące
ułatwieniu regeneracji nerwów.
Biomimetyka - naśladowanie struktur i procesów występujących w organizmach żywych
struktury laminatowe i włókniste
struktury gradientowe (gradient porowatości, modułu Younga, bioaktywności)
struktury inteligentne
procesy narastania hydroksyapatytu w SBF.
Wykład 13: Nano
Nano – 10
-9
(częśc bilionowa), R. Feynman. W nanoskali – specyficzne zjawiska (nieobserwowane dla materiałów mikrokrystalicznych.
Nanonauka- zajmuje się badaniem zjawisk i działaniem materiałów oraz manipulowaniem ich właściwościami w skalach: atomowej,
molekularnej i makromolekularnej (czyli tam gdzie właściwości różnią się znacznie od tych w skali makro).
Wymiar, przy którym występuje zmiana lub pojawiają się nowe właściwości jest graniczną wielkością definiującą nanomateriały.
Nanocząstki:
obiekty o wymiarach 0,1nm ÷ ok. 100nm (istnieją też nanocząstki 250nm)
w postaci manometrycznej muszą wykazywać właściwości, które nie występują w większej skali oraz muszą być wytworzone i
zastosowane w skali Nano.
kształty:
kule – zbudowane z pojedynczych atomów ułożonych w warstwę zwiniętą w kulę (np. fulereny węglowe),
rurki – warstwy pojedynczych atomów tworzące jedno i kilkuwarstwowe rurki (np. nanorurki węglowe, niewęglowe, organiczne
inne formy (np. płatki czy formy „kwiatopodobne”)
Nanotechnologia (Norio Taniguchi 1974r.)
dziedzina nauki powstała w latach 90tych ubiegłego wieku,
zajmuje się kontrolowanym tworzeniem materiałów funkcjonalnych, urządzeń i układów za pomocą kontroli w skali Nano (1-100nm),
wykorzystuje nowe zjawiska i właściwości materii (fizyczne, chemiczne, biologiczne),
zajmuje się metodami służącymi do ich badania i modelowania.
Cechy nanomateriałów (zmniejszając rozmiar uporządkowanych struktur materiałów można uzyskać lepsze wł. fizyko-chemiczne, mech.):
bardziej rozwinięta powierzchnia właściwa,
większa twardość,
większa wytrzymałość i wzrost plastyczności,
większa odporność na pełzanie,
większa biokompatybilność biomateriałów manometrycznych,
większa odporność chemiczna,
większa hydrofilowość,
właściwości ślizgowe,
wzmocnione zdolności adsorpcyjne i absorpcyjne,
unikalne właściwości magnetyczne.
Podział nanomateriałów ze względu na pochodzenie:
naturalne – utworzone niezależnie od człowieka oraz materiały zawierające nanoskładniki, znajdują się w atmosferze (sól morska, pył
wulkaniczny, drobny piasek w postaci kurzu, siarczany organiczne pochodzące z gazów biogenicznych oraz azotany jako pochodne NO
x
).
– ich zawartość w atmosferze zależna od położenia geograficznego,
antropogeniczne (uboczne) – utworzone w wyniku akcji człowieka (np. sadza, która powstaje w czasie palenia węgla kamiennego;
substancje zawierające opary spawalnicze, albo też inne powstające w trakcie utleniania, np. siarczany i azotany),
zaprojektowane przez człowieka i przez niego wytworzone, są syntezowane dla specjalnych celów i przybierają różne kształty.
Podział nanomateriałów ze względu na budowę:
materiały zerowymiarowe (n. punktowe) – zbudowane z osnowy, w której rozmieszczone są cząstki o wymiarach nanometrów,
Cel: otrzymanie materiału o kontrolowanych właściwościach mechanicznych
Problem: brak bioaktywnych materiałów ceramicznych w formie włókien do wzmacniania osnów polimerowych
materiały jedno- i dwuwymiarowe – warstwy o grubości nanometrycznej, zbudowane z jednej lub kilku substancji manometrycznych (np.
warstwy o grubości kilku nm Tylku jedno- lub wielofazowego),
materiały trójwymiarowe (nanokrystaliczne) – materiały homo- i heterogeniczne, zbudowane z kryształów o rozmiarach
manometrycznych.
Grupy nanomateriałów:
nanometale
nanocząstki złota – po wzbogaceniu związkami chemicznymi o odpowiednich właściwościach fizykochemicznych, potrafią w
kontakcie z białkami zmieniać kształt ich cząsteczek,
nanosrebro - nanocząstki (o rozmiarach >500 atomów w nanocząstce) posiadają właściwości bakterio- i grzybobójcze
nanoplatyna – nanocząstki stosowane jako katalizatory w ogniwach wodorowych i samochodowych, dzięki b. wysokiej aktywności
rozbudowanej powierzchni w stosunku do masy są b. wydajnym materiałem do zastosowania w przemyśle chemicznym jako
katalizatory reakcji.
nanoproszki tlenków metali
nanoceramika – nanoproszki ceramiczne
wielkość ziarna 1÷10nm (>100nm)
Gdy ziarno <100nm właściwości materiałów gwałtownie się zmieniają:
przewodnictwo cieplne – spada kilka razy
przesuwa się granica plastyczności materiału
odporność na ścieranie wzrasta ok. 4x
mikrotwardość wzrasta 2x
wytrzymałość mechaniczna rośnie ok. 4x
Problemy otrzymywania nanoproszków:
droga i skomplikowana produkcja
eliminacja aglomeracji proszków nanokrystalicznych
trudności we właściwym zagęszczeniu proszków nanokrystalicznych
minimalizacja procesu wzrostu ziarna podczas spiekania
Tlenek tytanu – ziarna o rozmiarach Nano odmiany rutylowej tlenku tytanu wykazują efekt fotokatalityczny (pod wpływem światła
(np. słonecznego) rozszczepiają na swojej powierzchni cząsteczki tlenu do jego reaktywnych form, po czym reagują ze związkami
organicznymi powodując ich utlenianie). Cel przyszłości – szkło z cechą samoczyszczenia.
Zastosowanie tl. tytanu: do farb kryjących, niszczenia przykrych zapachów (dezodoryzacja), wykazują efekt antyseptyczny,
w mleczkach i olejkach do opalania
ceramizery - nanocząstki tlenków krzemu, glinu i innych metali, w których przez nanorozmiar zwielokrotniono ich niebywałą
twardość co w połączeniu z możliwością przyłączania się do powierzchni obniża tarcie (->obniża zużycie współpracujących
elementów).
nanomateriały węglowe
półprzewodniki
nanokompozyty - podział na dwie grupy:
nanomatriały będące dodatkiem do już istniejących materiałów podwyższających ich własności mechaniczne,
nanokompozyty zbudowane od podstaw z nanomateriałów, łączące w sobie zalety wszystkich składników.
kompozyty polimerowe z mineralnymi napełniaczami (warstwowe glinokrzemiany)
Znane napełniacze:
1. naturalne krzemiany
2. syntetyczne krzemiany
3. nanostrukturalna krzemionka
4. nanoceramika (np. tlenek glinu, azotek krzemu itp.)
5. nanorurki
Nanocząstki glinokrzemianów (jako napełniacze) - wprowadzone do polimeru powodują:
Pozytywy:
Negatywy:
zwiększenie modułu elastyczności
wyższą stabilność termiczną
zwiększone właściwości barierowe
odporność na rozpuszczalniki organiczne
wyższy współczynnik tłumienia ognia
lepsze właściwości optyczne
niższy współczynnik rozszczerzalności liniowej
wysoki koszt
ograniczona dostępność
trudność z osiągnięciem odpowiedniego stopnie
dyspersji w matrycy polimerowej
Materiały nanokrystaliczne:
wielkość nanokryształu jest zbliżona do wielkości komórki elementarnej
oczekiwane właściwości:
Powierzchnia nanokryształu ma zawsze inną budowę niż jego wnętrze
Obszary badawcze nanonauki i nanotechnologii
1. Zjawiska i procesy w nanoskali
2. nanostruktury
wytrzymałość mechaniczna i twardość
dyfuzyjność
własności magnetyczne
oporność elektryczna
współczynnik rozszerzalności cieplnej
plastyczność
odporność na kruche pękanie
moduł sprężystości
przewodnictwo cieplne

3. nanomateriały i kompozyty
4. nanoelektronika i nanomagnetyzm
5. nanooptyka
6. urządzenia w nanoskali
7. nanoanalityka i nanometrologia
8. nanobio
9. nanomedycyna
10. procesy i urządzenia produkcyjne dla nanotechnologii
Ryzyko nanotechnologii:
oddziaływania na organizm ludzki (nieznany wpływ)
manipulacje biologiczne w skali Nano
nanocząstki, nanowłókna, nanomateriały stosowane w medycynie (mogą zachwiać równowagę ekosystemów)
Wyszukiwarka
Podobne podstrony:
pytania na zal - zgniot i rekrystalizacja, Materiały ze studiów, Nauka o materiałach, Zgniot i rekry
wykres zelazo cementyt, Studia, nauka o materiałach
Nauka o materiałach zagadnienia
Szczygieł, inżynieria materialów i nauka o materiałach, zagadnienia dla części metale
Nauka o materialach kolokwium1
Nauka o materialach I
NAUKA O MATERIAŁACH kompozyty
2 - Stale Konstrukcyjne Obrabiane Cieplnie, ZiIP, Semestr 2, Nauka o Materiałach z Elementami Chemii
RODZINNE UWARUNKOWANIA www przedszkola edu pl, Nauka, Materiały o przemocy w szkole
nauka o materiałach 2 laborki
nauka o materiaach pztania
Nauka o materialach test z roku 11
NAUKA O MATERIAŁACH ceramika
NAUKA O MATERIAŁACH stopyAl i Cu
6 proba jominyego, Nauka o materiałach
Temat2, Studia, nauka o materiałach
lab-rozciaganie, ZiIP UR Kraków, I Semestr, Nauka o materiałach
lab-Kraków-sciskanie-MTS, ZiIP UR Kraków, I Semestr, Nauka o materiałach
więcej podobnych podstron