1
Program ćwiczeń rachunkowych z chemii nieorganicznej dla kierunku:
Technologia Żywności i Żywienie Człowieka
Rok akademicki 2012/2013
Semestr I
1. Pojęcia podstawowe z chemii.
Symbolika i nazewnictwo podstawowych związków chemicznych, stosowane jednostki.
Podstawowe prawa chemiczne (prawo stałości składu chemicznego, prawo stosunków
wielokrotnych). Wyznaczanie wzorów empirycznych (najprostszych) i rzeczywistych w oparciu
o skład procentowy związków chemicznych lub analizę chemiczną.
2. Stechiometria.
Podstawowe obliczenia oparte na równaniach reakcji. Reakcje z udziałem gazów. Prawa
gazowe.
3. Stężenia roztworów.
Sposoby wyrażania stężeń, stężenia procentowe, molowe, ułamki molowe. Metody przeliczania
stężeń. Rozcieńczanie, zatężanie i mieszanie roztworów.
4. Kolokwium sprawdzające I.
5. Roztwory elektrolitów
Iloczyn jonowy wody. pH i pOH. Dysocjacja elektrolitów mocnych i słabych, stała i stopień
dysocjacji. Siła jonowa roztworów, aktywność i współczynniki aktywności. Wyznaczanie pH
roztworów mocnych i słabych elektrolitów.
Hydroliza soli. Roztwory buforowe. Wyznaczanie pH roztworów buforowych i soli
hydrolizujących
.
6. Kolokwium sprawdzające II.
Literatura:
1. Z. Galus, Ćwiczenia rachunkowe z chemii analitycznej, PWN, 1996
2. R. Sołoniewicz, A. Korczyński, Obliczenia chemiczne, skrypt PŁ, 1993
3. A. Śliwa, Obliczenia chemiczne, PWN, 1980
4. H. Całus, Podstawy obliczeń chemicznych, WNT, 1983
2
Cyfry znaczące
Każda z wielkości mierzalnych, tj. wyznaczanych przy użyciu urządzeń pomiarowych
(masa, objętość itd.) jest obarczona błędem związanym z dokładnością wykonywanych pomiarów.
Przyjmuje się, że wielkości te są podawane w taki sposób, aby jedynie ostatnia cyfra wielkości była
niepewna. Np. jeżeli dokonuje się pomiaru masy na wadze z dokładnością 0,1 g masę 0,1869 g
podaje się także z dokładnością do miejsc dziesiętnych, czyli 0,2 g.
W obliczeniach dotyczących wielkości mierzalnych decydujące znaczenie mają cyfry znaczące.
- cyfry od 1 do 9 są zawsze cyframi znaczącymi;
- cyfra 0 JEST cyfrą znaczącą, gdy znajduje się w środku liczby (np. 606) oraz gdy stanowi o
dokładności wielkości mierzalnej np. 0,2000 (dokładność pomiaru do miejsc
dziesięciotysięcznych);
- cyfra 0 NIE JEST cyfrą znaczącą, gdy świadczy o rzędzie wielkości np. 0,005 (cyfrą znaczącą
jest tylko 5).
Zaokrąglanie do cyfr znaczących następuje podczas obliczeń z wykorzystaniem wielkości
mierzalnych
- ostatniej cyfry znaczącej nie zmienia się, jeśli następująca po niej cyfra jest mniejsza od 5;
- ostatnią cyfrę znaczącą podnosi o jednostkę, jeśli następująca po niej cyfra jest większa od 5;
- jeśli następująca po niej cyfrą jest 5, ostatnia cyfra znacząca (niepewna) powinna być cyfrą
parzystą
Wyznaczanie liczby cyfr znaczących w obliczeniach:
- suma dodawania wielkości mierzalnych ma taką samą dokładność, jak najmniej dokładny
składnik, niezależnie od liczby cyfr znaczących, np. suma 12,025 i 2,1 wynosi 14,1 a nie
14,125, podobnie dzieje się przy odejmowaniu. W obu działaniach liczby zaokrągla się do
wymaganego rzędu dokładności PRZED wykonaniem działania;
- wynik mnożenia ma tyle cyfr znaczących, co czynnik z ich najmniejszą liczbą, np. wynik
mnożenia 2,566 (4 cyfry znaczące) i 0,0021 (2 cyfry znaczące) wynosi 0,0054 (2 cyfry
znaczące), a nie 0,0053886; podobnie dzieje się w przypadku dzielenia.
W każdym obliczeniu, w którym następuje przeliczanie wielkości mierzalnych, wynik podaje się po
znaku „ = ”, niezależnie od wykonanych przybliżeń dokładności.
3
ARKUSZ 1 Kierunek Technologia Żywności i Żywienie Człowieka
Związek chemiczny - substancja złożona z dwóch lub więcej pierwiastków, która ma właściwości
zachowania stałego składu, tzn. nie zmienia składu procentowego poszczególnych
pierwiastków podczas częściowej zmiany stanu.
Wzory chemiczne związków:
Wzór empiryczny - wskazuje najprostszy z możliwych wzorów, który określa stechiometryczny
skład danego związku.
Wzór cząsteczkowy (rzeczywisty) - zgodny z prawidłową masą molową związku, podaje się
wtedy, gdy związek złożony jest z określonych cząsteczek, np. H
2
S
2
O
8
a nie HSO
4
.
We wzorach chemicznych na pierwszym miejscu umieszcza się zawsze składnik bardziej
elektrododatni, np. H
2
O a nie OH
2
.
W przypadku związków niemetali, umieszcza się najpierw symbole pierwiastka, który zajmuje
wcześniejszą pozycję w podanym wykazie:
R n , X e , K r , B , S i , C , S b , A s , P , N , H , T e , S e , S , A t , I , B r , C l , O , F .
W związkach łańcuchowych, które zawierają trzy lub więcej pierwiastków, kolejność zapisu
powinna być zgodna z rzeczywistym połączeniem w cząsteczce lub jonie, np. NCS
-
a nie CNS
-
.
Jeżeli z jednym atomem centralnym łączą się dwa lub więcej atomów różnych pierwiastków,
wówczas zapisuje się symbol atomu centralnego, a pozostałe pierwiastki zapisuje się w
kolejności alfabetycznej ich symboli, np. PBCl
2
(istnieją wyjątki od tej zasady, np. we wzorach
kwasów).
Wzór cząsteczkowy wyraża zarówno jakościowy, jak i ilościowy skład związku. Obliczenia
wykonywane przy pomocy wzorów chemicznych, jak i równań chemicznych, noszą nazwę obliczeń
stechiometrycznych i są oparte na następujących prawach:
prawo zachowania masy – suma mas substancji reagujących nie ulega zmianie (suma mas
substratów jest równa sumie mas produktów reakcji)
prawo stałych stosunków wagowych – związek chemiczny posiada stały skład ilościowy
wskutek przereagowania pierwiastków w stałych stosunkach wagowych.
prawo stosunków wielokrotnych - jeżeli dwa pierwiastki tworzą kilka różnych związków
chemicznych, wówczas w związkach tych na tą samą ilość wagową jednego pierwiastka
przypadają ilości pierwiastka drugiego pozostające do siebie w stosunku niewielkich liczb
całkowitych.
prawo stosunków objętościowych - w reakcji chemicznej objętości gazów wyjściowych i
produktów gazowych, odmierzone w jednakowych warunkach temperatury i ciśnienia,
pozostają do siebie w prostych stosunkach liczbowych.

4
PIERWIASTEK - substancja chemiczna, składająca się z atomów tylko jednego rodzaju i na które
można rozłożyć metodami chemicznymi dowolną substancję.
Izotopy - rodzaje atomów tego samego pierwiastka różniące się liczbą neutronów w jądrze.
Oznaczenie pierwiastka:
gdzie x - liczba masowa, podawana dla zaznaczenia izotopu, określa sumę protonów i neutronów
zawartych w jądrze;
y - liczba atomowa, dodatkowo dla zaznaczenia izotopu, określa liczbę protonów
wchodzących w skład jądra;
z - liczba łączących się atomów;
w - ładunek, zapisywany cyfrą arabską, po której podaje się znak ładunku,
a - stopień utlenienia pierwiastka (cyfra rzymska).
STOPIEŃ UTLENIENIA PIERWIASTKA – teoretyczny ładunek, który istniałby na atomie tego
pierwiastka, gdyby elektrony w każdym wiązaniu, które tworzy ten atom, należały do atomu
bardziej elektroujemnego. Stopień utlenienia zaznacza się cyfrą rzymską nad symbolem
pierwiastka.
Obliczanie stopnia utlenienia pierwiastka:
w stanie elementarnym atomom przypisuje się stopień utlenienia równy zeru.;
np.
Na
0
H
2
0
w prostych jonach, składających się z jednego atomu, stopień utlenienia równa się ładunkowi
jonu; np.
Al
3+
III
S
2-
-II
w związkach zawierających tlen stopień utlenienia atomu tlenu wynosi -II;
WYJĄTKI
w nadtlenkach np. H
2
O
2
-I;
w difluorku tlenu OF
2
II.
w związkach zawierających wodór stopień utlenienia atomu wodoru wynosi I;
WYJĄTKI
w wodorkach litowców i berylowców np. NaH
-I
suma stopni utlenienia pierwiastków wchodzących w skład związku wynosi zero dla cząsteczek
obojętnych lub równa się ładunkowi wypadkowemu dla jonów.
np. H
2
O
2 * I + ( - II ) = 0
OH
-
I + ( - II ) = -1
Obliczanie nie dotyczy:
w cząsteczce atomy pierwiastków łączą się między sobą;
np. FeS
2
( Fe II, S -II)
Fe
S
S
w cząsteczce stopnie utlenienia tego samego pierwiastka są różne;
np. Na
2
S
2
O
3
S
O
O
O
S
Na
Na
VI
-II
pierwiastki w związku wykazują jednakowe lub zbliżone elektroujemności.
np. NCl
3
.
a
w
z
x
y
E

5
Nazewnictwo związków chemicznych w systemie Stocka
1. Nazewnictwo tlenków
Po słowie tlenek i nazwie łączącego się z tlenem pierwiastka (rzeczownik w dopełniaczu)
podawany jest stopień utlenienia pierwiastka, pisany cyfrą rzymską w nawiasie.
np.
NO
tlenek azotu(II)
NO
2
tlenek azotu(IV)
FeO
tlenek żelaza(II)
Fe
2
O
3
tlenek żelaza(III)
2. Nazewnictwo wodorotlenków
Nazwy wodorotlenków tworzy się podając nazwę „wodorotlenek” oraz nazwę pierwiastka w
dopełniaczu liczby pojedynczej. Gdy istnieją dwa lub więcej wodorotlenki tego samego metalu, po
nazwie pierwiastka podaje się jego stopień utlenienia cyfrą rzymską w nawiasie.
np.
NaOH
wodorotlenek sodu
Fe(OH)
2
wodorotlenek żelaza(II)
Fe(OH)
3
wodorotlenek żelaza(III)
3. Nazewnictwo kwasów
Nazwy kwasów tlenowych tworzy się podając nazwę „kwas’ oraz nazwę atomu centralnego w
postaci przymiotnika z końcówką -OWY. Stopień utlenienia atomu centralnego zaznacza się cyfrą
rzymską w nawiasie tuż za nazwą kwasu.
np.
HClO
kwas chlorowy(I)
HClO
2
kwas chlorowy(III)
HClO
3
kwas chlorowy(V)
Nazwy kwasów beztlenowych tworzy się od nazwy anionu, zakończonej na -EK.
np.
H
2
S
siarczek wodoru (dopuszczalna nazwa kwas siarkowodorowy)
4. Nazewnictwo anionów
Nazwy anionów jednoatomowych tworzy się od nazwy pierwiastka z dodaniem końcówki -EK lub
–IK, np.
F
-
fluorek
Cl
-
chlorek
Br
-
bromek
I
-
jodek
S
2-
siarczek
Nazwy niektórych anionów wieloatomowych także posiadają końcówkę -EK.
np.
OH
-
wodorotlenek
CN
-
cyjanek
Nazwy anionów wieloatomowych tworzy się przez dodanie do rdzenia nazwy atomu centralnego
końcówki -AN i stopnia utlenienia atomu centralnego w anionie (cyfrą rzymską w nawiasie),
np.
NO
3
-
azotan(V)
SO
3
2-
siarczan(IV)
SO
4
2-
siarczan(VI)
MnO
4
-
manganian(VII)
CO
3
2-
węglan
SCN
-
tiocyjanian
[Fe(CN)
6
]
4-
heksacyjanożelazian(II)
[Fe(CN)
6
]
3-
heksacyjanożelazian(III)
5. Nazewnictwo soli
nazwy soli kwasów beztlenowych zapisuje się od nazwy anionu z końcówką -EK, następnie
nazwa pierwiastka (metalu) w dopełniaczu liczby pojedynczej, a tuż za nazwą podaje się stopień
utlenienia atomu metalu (cyfrą rzymską w nawiasie).
np.
FeCl
2
chlorek żelaza(II)
FeCl
3
chlorek żelaza(III)
nazwy soli kwasów tlenowych zapisuje się od nazwy anionu z końcówką -AN, stopnia utlenienia
atomu centralnego w anionie (cyfrą rzymską w nawiasie), następnie nazwa pierwiastka (metalu)
w dopełniaczu liczby pojedynczej, a tuż za nazwą podaje się stopień utlenienia atomu metalu
(cyfrą rzymską w nawiasie).
np.
BaSO
4
siarczan(VI) baru
Fe(NO
3
)
2
azotan(V) żelaza(II)

6
Zadania:
1. Analiza pewnego związku wykazała, że składa się on z 26,28 % C, 2,24 % H i 71,08 % O.
Podać jego wzór najprostszy.
2. Dolomit zawiera 30,35 % tlenku wapnia, 21,54 % tlenku magnezu i 47,76 % ditlenku węgla.
Podać uproszczony wzór tego minerału.
3. Ile kg siarczanu(VI) żelaza(II) można otrzymać z 336 kg metalicznego żelaza ?
4. Jak zmieni się zawartość procentowa miedzi, jeżeli próbkę mineralną o składzie CuSO
4
.
5H
2
O
poddamy dehydratacji ?
5. Pewien związek składa się z węgla (46,15 %) i azotu (53,85 %), a jego masa molowa wynosi
51,9 g/mol. Podać wzór rzeczywisty tego związku.
6. Pewien związek wodoru i fosforu zawiera 93,89 % fosforu, a jego masa molowa wynosi
65,97 g/mol. Podać jego wzór rzeczywisty.
7. Podać wzór rzeczywisty związku, którego masa molowa wynosi 395,68 g/mol, a zawiera on
75,74 % As i 24,26 % O.
8. Przez działanie kwasem solnym na 1 g tlenku ołowiu(II) otrzymano 1,246 g chlorku ołowiu(II).
Obliczyć masę molową ołowiu.
9. Przez wyprażenie 5,50 g zanieczyszczonego węglanu cynku otrzymano 1,0567 g ditlenku
węgla. Podać procentową zawartość węglanu cynku w próbce.
10. Stwierdzono, że z 1,3520 g rudy miedzi można otrzymać 86,9 mg tlenku miedzi(II). Podać
procentową zawartość miedzi w rudzie.
11. Uwodniony siarczan(VI) magnezu zawiera 51,17 % wody krystalizacyjnej. Obliczyć liczbę
cząsteczek wody przypadających na jedną cząsteczkę siarczanu(VI) magnezu.
12. W jednym z tlenków azotu o masie molowej 92 g/mol na każdy 1 g azotu przypada 2,2840 g
tlenu. Podać wzór tlenku.
13. W próbce związku o masie 22,32 g stwierdzono obecność 2,42 g Mg, 7,09 g Cl, a resztę stanowi
tlen. Podać wzór tego związku.
14. W wyniku spalania 1,15 g pewnego związku organicznego otrzymano 2,20 g ditlenku węgla i
1,35 g wody. Masa molowa związku wynosi 46 g/mol. Podać wzór rzeczywisty związku.
15. Związek chemiczny składa się z: 25,93 % K, 13,03 % Co, 61,04 % NO
2
. Podać wzór
empiryczny.

7
ARKUSZ 2.
Kierunek Technologia Żywności i Żywienie Człowieka
Obliczenia stechiometryczne - oparte na wzorach związków i znajomości mas atomowych,
pozwalają w oparciu o prawidłowo ułożone równanie reakcji na rozwiązanie wielu zagadnień:
obliczenie składu procentowego związku;
obliczenie ilości produktu z zadanej ilości substratu;
obliczenie niezbędnej ilości substratów dla otrzymania żądanej ilości produktu;
obliczenie ilości jednego substratu reagującej całkowicie z daną ilością innych substratów;
obliczenie ilości substancji nie przereagowanych, gdy jeden z substratów był użyty w nadmiarze.
Równanie reakcji chemicznej mówi nam o tym, w jakich stosunkach liczbowych reagują ze sobą
atomy i cząsteczki substancji. Jeżeli znamy ich masy molowe, możemy obliczyć również
stosunki masowe wszystkich reagentów.
Często reakcje nie przebiegają całkowicie i wówczas obliczenie wydajności reakcji opiera się na
porównaniu ilości rzeczywiście otrzymanego produktu z ilością, która powinna się wytworzyć
zgodnie z równaniem reakcji (przy 100 % wydajności).
Założenia gazu doskonałego:
cząsteczki gazu są tak małe, że można je uważać za punkty materialne;
pomiędzy cząsteczkami gazu nie występują siły wzajemnego przyciągania ani odpychania;
cząsteczki gazu poruszają się stale i bezładnie po torach prostoliniowych, zderzając się ze
sobą i ścianami naczynia, w którym się znajdują;
zderzenia cząsteczek są doskonale sprężyste;
średnia energia kinetyczna cząsteczek jest proporcjonalna do temperatury gazu wyrażonej w
kelwinach.
Prawo Avogadra - równe objętości różnych gazów w tej samej temperaturze i pod tym samym
ciśnieniem zawierają jednakową liczbę cząstek.
Objętość molowa gazu doskonałego w warunkach normalnych ( 0
C, 760 mm Hg) wynosi
V
mol
= 22,4 dm
3
/mol.
Prawo stosunków objętościowych (prawo Gay - Lussaca) - w reakcji chemicznej objętości gazów
wyjściowych i produktów gazowych, odmierzone w jednakowych warunkach temperatury
i ciśnienia, pozostają do siebie w prostych stosunkach liczbowych.
Równanie stanu gazu doskonałego:
pV = nRT
gdzie p - ciśnienie gazu [ Pa ];
V - objętość gazu [ m
3
];
n - liczba moli gazu [ mol ];
R - stała gazowa;
T - temperatura gazu [ K ].
Stała gazowa - określa pracę 1 mola gazu ogrzanego o 1 kelwin pod stałym ciśnieniem.
R = 8,314
J
mol
K
Równanie stanu gazu doskonałego dla 1 mola gazu nosi nazwę równania Clapeyrona:
pV = RT

8
Równanie stanu gazu rzeczywistego (równanie Van der Waalsa) dla 1 mola gazu
p
V
+
a
V
- b = RT
2
gdzie a, b - stałe dla danego rodzaju gazu.
Gęstość bezwzględna gazu doskonałego w warunkach normalnych wynosi:
mol
V
M
d
[g/dm
3
]
Gdy znamy gęstość względną gazu w stosunku do drugiego gazu o masie molowej M
Y
, to nieznaną
masę molową gazu M
X
obliczamy ze wzoru:
M
X
= D
X/Y
.
M
Y
gdzie
Y
X
Y
/
X
d
d
D
Jednostki ciśnienia
paskal [ Pa ] - jednostka ciśnienia w układzie SI
2
m
N
1
Pa
1
atmosfera techniczna [ at ]
1 at = 735,5 mm Hg
atmosfera fizyczna [ atm ]
1 atm = 760 mm Hg = 1,013
.
10
5
Pa
bar
1 bar = 10
5
Pa = 750 mm Hg
tor [ Tr ]
1 Tr = 1 mm Hg = 133,3 Pa

9
Zadania:
1. Dla określenia zawartości żelaza i glinu w roztworze wytrącono wodorotlenki tych metali i
przeprowadzono je w odpowiednie tlenki (Fe
2
O
3
i Al
2
O
3
). Ile gramów żelaza i glinu zawierał
roztwór, jeżeli otrzymano łącznie 1,25 g tlenków, a masa siarczku żelaza(III) jaką można
otrzymać z tego roztworu wynosi 0,72 g.
2. Do roztworu zawierającego 6,0 g zasady sodowej dodano roztwór zawierający 10,0 g kwasu
azotowego. Jakie substancje i w jakiej ilości, oprócz wody, są obecne w roztworze?
3. Ile gramów tlenku żelaza(III) można otrzymać wyprażając 10 g chlorku żelaza(III) z 5,0 %
zawartością zanieczyszczeń ?
4. Ile gramów tlenu otrzyma się przez rozkład termiczny 100 g manganianu(VII) potasu,
zachodzący z wydajnością 85 %, jeżeli rozkład zachodzi według równania:
4 KMnO
4
2 K
2
MnO
3
+ 2 MnO
2
+ 3O
2
5. Ile gramów wodoru otrzyma się rozpuszczając w kwasie 1,00 kg magnalu - stopu zawierającego
20 % glinu i 80 % magnezu? Jaka to objętość w warunkach normalnych?
6. Mieszanina węglanu wapnia i tlenku wapnia traci po wyprażeniu 12,55 % swojej masy.
Obliczyć skład procentowy mieszaniny.
7. Mieszaninę 100 g tlenku miedzi(II) i 225 g tlenku srebra(I) zredukowano do metali. Obliczyć
skład procentowy otrzymanego stopu.
8. Naważkę 100 g miedzi ogrzano ze 100 g siarki. Powstał siarczek miedzi(I). Jaka substancja
pozostała w nadmiarze?
9. Odważono 0,2774 g mieszaniny chlorku sodu i chlorku potasu, rozpuszczono w wodzie, a
następnie strącono chlorki azotanem(V) srebra, otrzymując 0,609 g chlorku srebra(I). Znaleźć
procentową zawartość obu chlorków w mieszaninie wyjściowej.
10. Pewna substancja organiczna zawiera 77,5 % węgla, 7,5 % wodoru i 15,0 % azotu.
Wyprowadzić wzór rzeczywisty tej substancji, jeśli gęstość jej par względem powietrza (M
śr
=
29 g/mol) wynosi 3,21.
11. Rozpuszczono w kwasie 6,00 g technicznego siarczku żelaza(II) zawierającego 5% domieszkę
metalicznego żelaza. Jaka będzie objętość wydzielonych gazów w warunkach normalnych? Jaki
jest skład procentowy mieszaniny gazowej (wyrażony w procentach objętościowych)?
12. Termiczny rozkład tlenku ołowiu(IV) zachodzi według równania: 3PbO
2
Pb
3
O
4
+ O
2
.
Obliczyć objętość wydzielonego tlenu w warunkach normalnych, jeśli rozkładowi uległo 180 g
tlenku. Jaką objętość zajmuje tlen w temperaturze 27
C i pod ciśnieniem 2034 hPa?
13. W celu otrzymania chlorowodoru sporządzono 1,00 g mieszaniny chloru i wodoru o łącznej
objętości 500 cm
3
(warunki normalne). Który z substratów użyto w nadmiarze i jaką otrzymano
masę chlorowodoru ?

10
ARKUSZ 3.
Kierunek Technologia Żywności i Żywienie Człowieka
Definicje stężeń.
1. Stężenie procentowe
a) wyrażone w procentach wagowych (% m/m), określa liczbę gramów rozpuszczonej
substancji zawartych w 100 g roztworu.
V
d
%
100
m
m
%
100
m
c
s
r
s
p
gdzie m
s
– masa substancji rozpuszczonej
m
r
– masa roztworu
V – objętość roztworu
d – gęstość roztworu
b) wyrażone w procentach objętościowych (% v/v), określa liczbę cm
3
substancji
rozpuszczonej w 100 cm
3
roztworu
c) wyrażone z procentach masowo-objętościowych (% m/v), określa liczbę gramów
substancji rozpuszczonej w 100 cm
3
roztworu.
2. Stężenie molowe określa liczbę moli substancji zawartych w 1 dm
3
roztworu.
V
M
m
V
n
c
s
m
3
dm
mol
gdzie n – liczba moli substancji rozpuszczonej
V – objętość roztworu
m
s
– masa substancji rozpuszczonej
M – masa molowa substancji rozpuszczonej
Stężenie molowe substancji AB może być zapisywane w sposób:
c(AB) = c
AB
= [AB]
3. Stężenie podane jako ułamek molowy wyraża stosunek liczby moli danego składnika do sumy
liczby moli wszystkich składników roztworu. Suma ułamków molowych wszystkich
składników roztworu równa się jedności.
m
2
1
i
i
i
n
...
n
n
n
n
n
x
4. Stężenie normalne określa liczbę gramorównoważników substancji zawartych w 1 dm
3
roztworu. Zgodnie z nową nomenklaturą stężenie normalne nie jest zalecane. Starsze
podręczniki zawierają jednak takie jednostki.
Gęstość roztworu
3
r
cm
g
V
m
d
1 g/dm
3
= 0,001 g/cm
3
1 g/cm
3
= 1000 g/dm
3

11
Zadania:
1. 5 cm
3
stężonego roztworu wodorotlenku potasu rozcieńczono wodą do objętości 250 cm
3
. Na
zobojętnienie 20,0 cm
3
tego roztworu zużyto 12,8 cm
3
roztworu kwasu solnego 0,25-
molowego. Jakie było stężenie molowe stężonego roztworu użytej zasady?
2. Do 200 cm
3
16,0 % roztworu wodorotlenku potasu o gęstości 1,150 g/cm
3
dodano 300 cm
3
roztworu wodorotlenku potasu o stężeniu 0,20 mol/dm
3
. Obliczyć stężenie molowe
otrzymanego roztworu.
3. Do 200 cm
3
20,0 % roztworu wodorotlenku potasu o gęstości 1,240 g/cm
3
dodano 300 cm
3
roztworu kwasu azotowego(V) 4,20 molowego. Obliczyć stężenie nieprzereagowanego
odczynnika.
4. Do 200 cm
3
roztworu wodorotlenku potasu 0,40 molowego (d = 1,02 g/cm
3
) dodano jeszcze
16,0 g stałej zasady. Obliczyć stężenie procentowe i molowe otrzymanego roztworu przy
założeniu, że objętość roztworu nie uległa zmianie.
5. Do 50,0 cm
3
roztworu chlorku baru o stężeniu 0,04 mol/dm
3
dodano 32 cm
3
2 % roztworu
kwasu siarkowego(VI) (d = 1,012 g/cm
3
). Podać, który odczynnik został użyty w nadmiarze.
Obliczyć stężenie nieprzereagowanego odczynnika i ile moli siarczanu(VI) baru powstało.
6. Do 54 g stałego wodorotlenku potasu dodano tyle wody, że otrzymano roztwór 20,0 %
(d = 1,186 g/cm
3
). Ile wody dodano, jaka była objętość roztworu i jego stężenie molowe?
7. Ile cm
3
10,0 % roztworu kwasu siarkowego(VI) (d = 1,070 g/cm
3
) zużyje się do całkowitego
zobojętnienia 16 g wodorotlenku sodu?
8. Ile cm
3
kwasu siarkowego(VI) 90 % (d = 1,814 g/cm
3
) i 36 % (d = 1,268 g/cm
3
) należy użyć,
aby otrzymać 2 dm
3
kwasu 65 % (d = 1,553 g/cm
3
).
9. Ile cm
3
wody należy dodać do 25 cm
3
27 % roztworu wodorotlenku potasu o gęstości
1,25 g/cm
3
aby otrzymać roztwór 0,20 molowy ?
10. Jak przygotować z 15,0 % roztworu węglanu sodu (d = 1,186 g/cm
3
) 5 dm
3
roztworu o
stężeniu 0,25 mol/dm
3
.
11. Jaką objętość 0,05 molowego roztworu wodorotlenku sodu należy dodać do 200 cm
3
0,12-molowego roztworu tej zasady aby otrzymać roztwór 0,10 molowy ?
12. Jaką objętość 25 % roztworu amoniaku o gęstości 0,910 g/cm
3
należy dodać do 500 cm
3
roztworu 0,20 molowego aby otrzymać roztwór o stężeniu 1,00 mol/dm
3
.
13. Na zobojętnienie 20 cm
3
roztworu kwasu siarkowego(VI) o stężeniu 0,15 mol/dm
3
zużyto
14,4 cm
3
roztworu wodorotlenku sodu. Ile gramów wodorotlenku sodu zawiera 1 dm
3
roztworu
wodorotlenku?
14. Obliczyć objętość 96 % roztworu kwasu siarkowego(VI) o gęstości 1,842 g/cm
3
potrzebną do
otrzymania 1,4 dm
3
roztworu o stężeniu 0,80 mol/dm
3
.
15. Zmieszano 120 g 80,0 % roztworu kwasu siarkowego(VI) (d = 1,727 g/cm
3
) z 500 cm
3
36 %
roztworu tego kwasu (d = 1,268 g/cm
3
). Jakie jest stężenie procentowe i molowe roztworu ?

12
ARKUSZ 4.
Kierunek Technologia Żywności i Żywienie Człowieka
Dysocjacja – rozpad cząsteczek na jony pod wpływem rozpuszczalnika; ulegają jej substancje o
budowie jonowej lub z wiązaniami spolaryzowanymi (dipole). Dysocjacja może być
całkowita (elektrolity mocne) lub częściowa (elektrolity słabe).
AB
A
+
+ B
-
Aktywność jonów – opisuje zjawisko oddziaływań elektrostatycznych jonów w roztworach
bardziej stężonych, ograniczających ruch jonów
f
c
a
gdzie a – aktywność jonu
c – stężenie molowe jonu
f – współczynnik aktywności jonu
Współczynnik aktywności jonu zależy od rodzaju jonu, jego ładunku, od stężenia i ładunku
innych jonów w roztworze.
Moc (siła) jonowa roztworu – miara oddziaływań międzyjonowych w roztworze
2
n
n
2
2
2
2
1
1
2
z
c
...
z
c
z
c
2
1
z
c
2
1
gdzie
- moc jonowa roztworu, [mol/dm
3
]
c – stężenie molowe jonu
z – ładunek jonu
Wartość współczynnika aktywności w roztworach rozcieńczonych jest równy 1, dla roztworów
bardziej stężonych f < 1, przy czym jego wartość liczbową wyznacza się eksperymentalnie lub ze
wzoru uproszczonego prawa granicznego Debye’a-Hückla:
1
z
0,5
f
log
2
gdzie z – ładunek jonu
- siła (moc) jonowa roztworu
Wzór ten stosuje się dla jonów jednowartościowych dla
0,05, dla jonów dwuwartościowych dla
0,014 i dla trójwartościowych przy
0,005. W przypadku roztworów bardziej stężonych
wartości współczynników aktywności obliczone przy użyciu powyższego wzoru są jedynie
przybliżone.
Stała dysocjacji (K) – opisuje równowagę pomiędzy jonami a cząsteczkami niezdysocjowanymi
]
AB
[
]
B
[
]
A
[
K
gdzie [A
+
], [B
-
] – stężenia jonów
[AB] – stężenie cząsteczek niezdysocjowanych
13
Stopień dysocjacji – stosunek liczby cząsteczek zdysocjowanych do ogólnej liczby cząsteczek
elektrolitu w roztworze; zależy od stężenia roztworu, temperatury, stałej dysocjacji i
obecności innych jonów w roztworze;
c
c
0 <
1 lub 0 % <
100 %
gdzie c
- stężenie cząsteczek zdysocjowanych
c – całkowite stężenie cząsteczek
1
c
K
2
lub dla
0,01 (10 %): K = c
.
2
Iloczyn jonowy wody – określa zależność pomiędzy jonami wodorowymi (hydroniowymi) i
wodorotlenowymi we wszystkich roztworach wodnych.
K
w
= K
.
[H
2
O] = [H
+
]
.
[OH
-
] = 10
-14
dla 25
C
lub pK
w
= pH + pOH = 14
gdzie pK
w
= - log K
w
pH = - log [H
+
]
pOH = - log [OH
-
]
pH – ujemny logarytm ze stężenia jonów wodorowych w roztworze
Wzór wyznaczający :
Sposób obliczania
pH roztworu mocnego kwasu
pH =
– log c
kw
(*)
pH roztworu mocnej zasady
pH = 14 + log c
zas
(**)
pH roztworu słabego kwasu
kw
kw
kw
c
K
c
]
H
[
kw
c
log
2
1
pK
2
1
pH
kw
pH roztworu słabej zasady
zas
zas
14
zas
14
c
K
10
c
10
]
H
[
zas
c
log
2
1
pK
2
1
14
pH
zas
gdzie pK
kw
, pK
zas
– wartość ujemnego logarytmu ze stałej dysocjacji słabego kwasu/słabej zasady
c
kw,
c
zas
– stężenie molowe kwasu / zasady
* - dla kwasów jednoprotonowych HA
** - dla zasad jednowodorotlenowych BOH

14
Zadania:
1. Amoniak o objętości 305 dm
3
, mierzony w temperaturze 25
C i pod ciśnieniem 1 bara,
rozpuszczono w wodzie, a otrzymany roztwór wykazywał pH 11,5. Jaka była objętość
otrzymanego roztworu?
2. Do 100 cm
3
0,1-molowego roztworu kwasu octowego dodano 120 cm
3
0,08-molowego
roztworu wodorotlenku baru. Obliczyć pH roztworu końcowego.
3. Do 20 cm
3
roztworu kwasu siarkowego(VI) dodano 30 cm
3
roztworu wodorotlenku amonu o pH
= 10,87. Roztwór po reakcji wykazywał pH 4,00. Obliczyć stężenie wyjściowe roztworu kwasu
siarkowego(VI). K = 1,77
.
10
-5
.
4. Do 30 cm
3
roztworu wodorotlenku baru o pH 11,70 dodano 0,1-molowego roztworu kwasu
solnego tak, że pH po reakcji wynosiło 7,80. Jaką objętość roztworu kwasu solnego dodano?
5. Do 300 cm
3
0,01-molowego roztworu wodorotlenku sodu dodano 200 cm
3
0,015-molowego
roztworu kwasu siarkowego(VI). Obliczyć pH roztworu końcowego.
6. Do kolby miarowej wprowadzono 2 g 5 % roztworu kwasu octowego i rozcieńczono wodą do
objętości 2 dm
3
. Obliczyć pH otrzymanego roztworu oraz stopień dysocjacji kwasu.
7. Jak zmieni się pH 0,0125-molowego roztworu wodorotlenku sodu, jeżeli 5 cm
3
tego roztworu
zmieszamy z 495 cm
3
wody?
8. Jakie jest stężenie molowe jonów hydroksylowych w 5,1 % roztworu amoniaku o gęstości
0,97 g/cm
3
. ( K = 1,77
.
10
-5
)
9. Obliczyć stałą dysocjacji kwasu, którego 0,01-molowy roztwór wykazuje pH = 5,1.
10. Obliczyć współczynnik aktywności jonów cynku w 1 dm
3
0,005-molowego roztworu
siarczanu(VI) cynku, a następnie po dodaniu do tego roztworu 100 cm
3
0,1-molowego roztworu
kwasu siarkowego(VI).
11. Obliczyć wykładnik stężenia jonów wodorowych (pH) i wykładnik aktywności jonów
wodorowych (p
a
H) w 0,02-molowym i 0,002-molowym roztworze kwasu siarkowego(VI).
12. Po reakcji 2 cm
3
30 % roztworu kwasu siarkowego(VI) (d = 1,224 g/cm
3
) z 0,1 g cynku,
roztwór rozcieńczono do 1 dm
3
. Obliczyć pH otrzymanego roztworu.
13. Roztwór kwasu octowego o objętości 20 cm
3
rozcieńczono wodą do 1 dm
3
, a po rozcieńczeniu
pH wynosiło 3,50. Jakie było pierwotne stężenie kwasu?
14. Stopień dysocjacji 0,1-molowego roztworu kwasu octowego wynosi 1,35 %. Przy jakim
stężeniu roztworu tego kwasu stopień dysocjacji osiągnie wartość 95 % ?
15. Zmieszano 200 ml 0,05-molowego roztworu kwasu chlorowego(VII) i 300 ml 0,01-molowego
roztworu kwasu solnego. Do otrzymanego roztworu dodano 2 g wodorotlenku potasu. Jakie
było pH roztworu końcowego?

15
ARKUSZ 5.
Kierunek Technologia Żywności i Żywienie Człowieka
Hydroliza - reakcja związku chemicznego z wodą. W przypadku soli słabych elektrolitów,
hydroliza jest odwracalna i odwrotna do reakcji zobojętniania. Zgodnie z teorią
Brönsteda sole hydrolizujące są słabymi kwasami lub zasadami, które w reakcji z
wodą ulegają zobojętnieniu.
Hydrolizie ulegają sole słabych elektrolitów, tzn.:
- sole słabych kwasów i mocnych zasad
Na
COO
CH
COONa
CH
3
3
(dysocjacja)
OH
COOH
CH
O
H
COO
CH
3
2
3
odczyn zasadowy
- sole słabych zasad i mocnych kwasów
Cl
NH
Cl
NH
4
4
(dysocjacja)
H
O
H
NH
O
H
NH
2
3
2
4
odczyn kwaśny
- sole słabych kwasów i słabych zasad
4
3
4
3
NH
COO
CH
COONH
CH
(dysocjacja)
OH
COOH
CH
O
H
COO
CH
3
2
3
H
O
H
NH
O
H
NH
2
3
2
4
odczyn obojętny, słabo kwaśny lub słabo zasadowy, w zależności od wartości odpowiednich stałych
dysocjacji kwasu i zasady.
Wielkości charakteryzujące proces hydrolizy :
- stała hydrolizy K
h
(stała reakcji odwracalnej)
dys
w
K
K
h
K
gdzie K
w
- iloczyn jonowy wody
K
dys
- stała dysocjacji słabego kwasu lub słabej zasady
lub
zas
h
K
K
kw
w
K
K
jeżeli sól tworzą słaby kwas i słaba zasada
- stopień hydrolizy h ( 0
h
1 )
soli
czasteczek
liczba
calkowita
soli
czasteczek
wanych
zhydrolizo
liczba
h
=
c
c
h
h
-
1
c
c
h
c
h
K
h
; dla h
0,01 K
h
= c
.
h
2
c
K
h
h
gdzie K
h
- stała hydrolizy
c - stężenie soli [mol/dm
3
]
Wartość pH roztworów soli hydrolizujących oblicza się ze wzorów :
- dla soli słabych zasad jednowodorotlenowych, np. NH
4
Cl
zas
w
K
c
K
h
c
H
sól
zas
c
log
2
1
pK
2
1
7
pH
- dla soli słabych kwasów jednowodorowych, np. CH
3
COONa
c
K
K
h
c
K
H
kw
w
w
sól
kw
c
log
2
1
pK
2
1
7
pH

16
Bufory są to roztwory zawierające słaby kwas oraz jego sól z mocną zasadą lub słabą zasadę i
jej sól z mocnym kwasem, bądź roztwory wodorosoli kwasów wieloprotonowych. Bufory wykazują
stałość wykładnika pH podczas rozcieńczania wodą lub dodawania niewielkich ilości kwasów albo
zasad. Roztwór słabego kwasu i jego soli jest odporny na większe zmiany pH, bowiem mała ilość
jonów wodorowych dodana do roztworu powoduje, że większość jonów wodorowych jest wiązana
przez aniony, tworząc słaby kwas, zdysocjowany tylko w niewielkim stopniu i w rezultacie zmiana
stężenia jonów wodorowych w roztworze jest mała. Natomiast dodanie silnej zasady do roztworu
słabego kwasu powoduje zobojętnianie zasady i zmiany pH również są niewielkie aż do momentu,
kiedy większość kwasu zostanie zobojętniona.
Zakres wartości pH, w którym dana mieszanina buforowa wykazuje działanie buforujące,
zależy od wartości stałej dysocjacji i od stosunku stężeń składników mieszaniny buforowej.
Słaby kwas i jego sól
sol
kw
kw
c
c
K
]
H
[
sol
kw
kw
c
c
log
pK
pH
Słaba zasada i jej sól
zas
sól
zas
w
c
c
K
K
]
H
[
sol
zas
zas
w
c
c
log
pK
pK
pH
Dana mieszanina buforowa wykazuje własności buforujące w zakresie od pH = pK
kw
- 1 do
pH = pK
kw
+ 1; działanie jej jest ograniczone, a skuteczność przeciwdziałania zmianom pH jest
określona pojemnością buforową. Liczba moli mocnej zasady, bądź mocnego kwasu, która musi
być dodana do 1dm
3
roztworu, aby spowodować zmianę pH o jedną jednostkę określa pojemność
buforową danego roztworu.
pH
Z
Z - ilość dodanej zasady (kwasu),
pH - przyrost pH.
W miarę dodawania mocnego kwasu lub zasady pojemność buforowa maleje osiągając w końcu
wartość zerową, gdy cała zawarta w buforze sól przejdzie w słaby kwas lub gdy słaby kwas
zostanie zastąpiony solą. Największą pojemność buforową mają roztwory, w których c
sol
= c
kw
, c
zas
= c
sol
i pH = pK
kw
lub pH = pK
zas
. Rozcieńczanie buforów nie zmienia pH, ale obniża
.

17
Zadania
1. 600 cm
3
roztworu zawiera 0,15 mola amoniaku i 0,12 mola chlorku amonu. Jak zmieni się pH,
jeżeli do roztworu dodano 400 cm
3
:
a) wody destylowanej,
b) roztworu azotanu(V) amonu o stężeniu 0,1 mol/dm
3
,
c) buforu otrzymanego przez zmieszanie 500 cm
3
roztworu amoniaku o stężeniu 0,12 mol/dm
3
z 500 cm
3
roztworu azotanu(V) amonu o stężeniu 0,15 mol/dm
3
.
Obliczyć zmianę pH w każdym z roztworów. ( K
zas
= 1,85
.
10
-5
)
2. Do 1 dm
3
roztworu zawierającego 0,1 mol kwasu octowego, 0,1 mol octanu sodu dodano
a) 10 cm
3
1 molowego roztworu kwasu solnego,
b) 750 cm
3
wody.
Jak zmieni się pH roztworu? ( K
kw
= 1,85
.
10
-5
)
3. Do 100 cm
3
roztworu kwasu octowego o stężeniu 0,5 mol/dm
3
dodano 4,63 g octanu sodu, a
następnie roztwór rozcieńczono wodą destylowaną do objętości 250 cm
3
. Obliczyć pH
otrzymanego roztworu. ( K
kw
= 1,85
.
10
-5
)
4. Do 200 cm
3
roztworu kwasu solnego o stężeniu 0,5 mol/dm
3
wprowadzono ilościowo 4,48 dm
3
gazowego amoniaku (objętość mierzono pod ciśnieniem 3 atm w temp. 20
C). Jakie jest pH
otrzymanego roztworu ? ( K
zas
= 1,8
.
10
-5
).
5. Do objętości 20,8 cm
3
0,11-molowego kwasu mrówkowego dodano 20 cm
3
0,1-molowego
wodorotlenku sodu. Obliczyć pH powstałego roztworu. ( K
kw
= 1,76
.
10
-4
)
6. Ile gramów octanu sodu należy rozpuścić w 0,5 dm
3
0,2 molowego roztworu kwasu octowego,
aby pH otrzymanego buforu różniło się dwie jednostki od pH roztworu kwasu octowego ?
( K
kw
= 1,85
.
10
-5
)
7. Jak zmieni się pH roztworu chlorku amonu o stężeniu 0,03-molowym, jeżeli do 100 cm
3
tego
roztworu dodano 400 cm
3
wody ? ( K
zas
= 1,8
.
10
-5
)
8. Jak zmieni się pH roztworu octanu potasu o stężeniu 0,05-molowym, jeżeli do 150 cm
3
tego
roztworu dodano 5 g tej soli ? ( K
kw
= 1,85
.
10
-5
)
9. Jak zmienił się stopień hydrolizy octanu potasu, jeżeli 50 cm
3
0,1-molowego roztworu
pierwotnego rozcieńczono wodą do objętości końcowej 250 cm
3
? ( K
kw
= 1,85
.
10
-5
)
10. Obliczyć pH 0,05-molowego roztworu węglanu sodu. ( pK
1
= 6,4; pK
2
= 10,3 )
11. Obliczyć pH w 0,75 % roztworze azotanu(V) amonu. ( K
zas
= 1,8
.
10
-5
; przyjąć d = 1 g/cm
3
)
12. Obliczyć stałą dysocjacji kwasu cyjanowodorowego, jeżeli w 0,05-molowym roztworze
cyjanku potasu stopień hydrolizy cząsteczek soli wynosi 0,053.
13. Roztwór zawiera 0,056 mola amoniaku i 0,1 mola chlorku amonu w 1 dm
3
. Obliczyć pH tego
roztworu przed i po dodaniu 0,02 mola wodorotlenku sodu lub 0,02 mola kwasu solnego.
K
zas
= 1,8
.
10
-5
14. W skład dwóch roztworów buforowych wchodzą sole NaH
2
PO
4
, i Na
2
HPO
4
:
a) roztwór zawiera 0,500 mola NaH
2
PO
4
i 0,310 mola Na
2
HPO
4
w 1dm
3
,
b) roztwór zawiera 0,100 mola NaH
2
PO
4
i 0,062 mola Na
2
HPO
4
w 1dm
3
.
Do roztworów dodano tyle wodorotlenku sodu, że stężenie molowe wodorotlenku w nich było
jednakowe i wynosiło 0,025 mol/dm
3
. Obliczyć zmianę pH dla każdego z nich. K
k2
= 6,62
.
10
-8
.
18
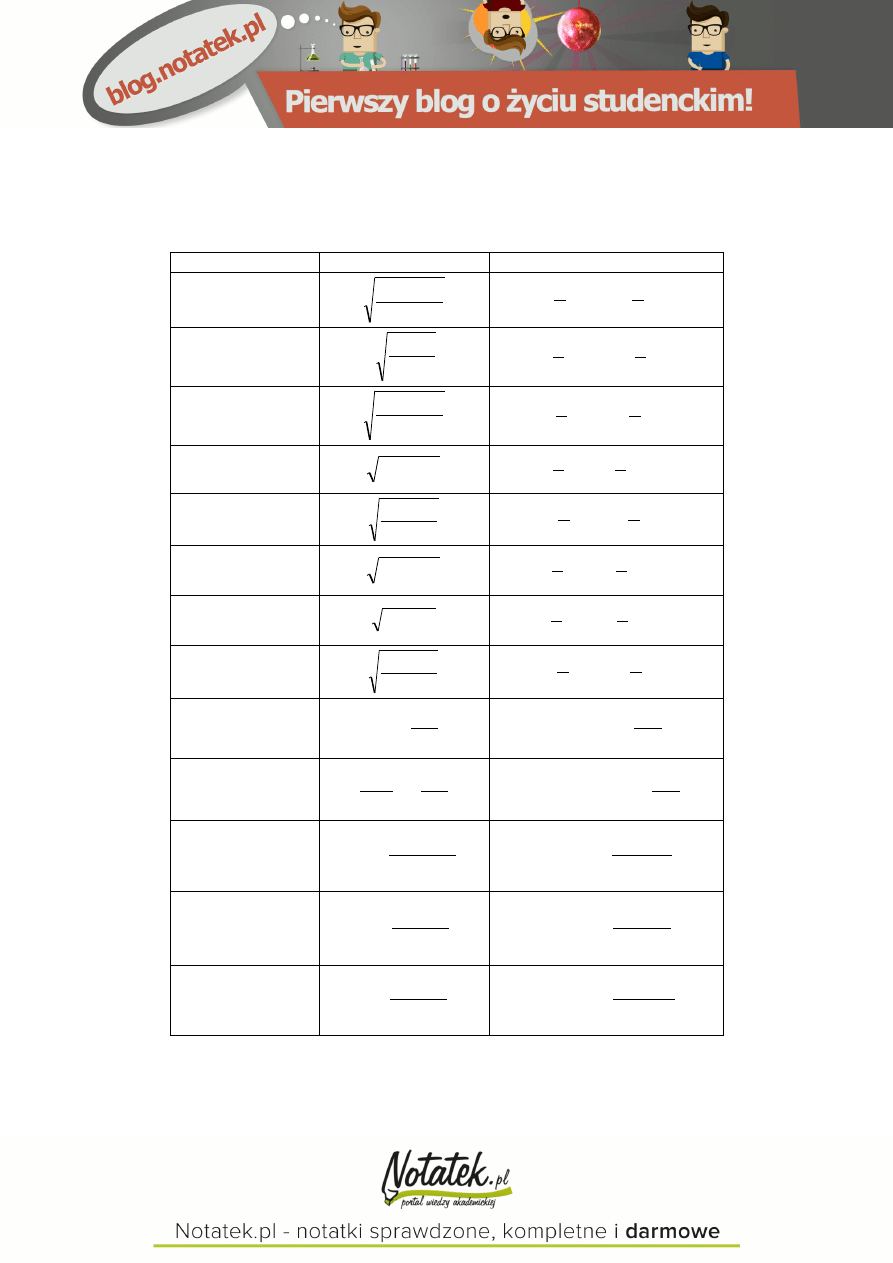
Wyznaczanie pH roztworów soli hydrolizujących i buforów
Roztwór zawiera:
[H
+
]
pH
CH
3
COONa
c
K
K
kw
w
c
log
2
1
pK
2
1
7
kw
NH
4
Cl
zas
w
K
c
K
c
log
2
1
pK
2
1
7
zas
CH
3
COONH
4
zas
kw
w
K
K
K
zas
kw
pK
2
1
pK
2
1
7
NaHCO
3
2
1
K
K
2
1
pK
2
1
pK
2
1
Na
2
CO
3
c
K
K
2
w
c
log
2
1
pK
2
1
7
2
NaH
2
PO
4
2
1
K
K
2
1
pK
2
1
pK
2
1
Na
2
HPO
4
3
2
K
K
3
2
pK
2
1
pK
2
1
Na
3
PO
4
c
K
K
3
w
c
log
2
1
pK
2
1
7
3
CH
3
COOH i
CH
3
COONa
sol
kw
kw
c
c
K
sol
kw
kw
c
c
log
pK
NH
3
.
H
2
O i NH
4
Cl
zas
sól
zas
w
c
c
K
K
sol
zas
zas
c
c
log
pK
14
Na
3
PO
4
i Na
2
HPO
4
4
3
4
2
PO
Na
HPO
Na
3
c
c
K
4
3
2
PO
Na
4
HPO
Na
3
c
c
log
pK
Na
2
HPO
4
i
NaH
2
PO
4
4
2
4
2
HPO
Na
PO
NaH
2
c
c
K
4
2
4
2
HPO
Na
PO
NaH
2
c
c
log
pK
NaH
2
PO
4
i H
3
PO
4
4
2
4
3
PO
NaH
PO
H
1
c
c
K
4
2
4
3
PO
NaH
PO
H
1
c
c
log
pK

19
Odpowiedzi do zadań.
Arkusz 1.
1) CHO
2
2) CaO
.
MgO
.
2CO
2
3) 913,9 kg
4) wzrośnie z 25,4% do 39,8%.
5) C
2
N
2
6) P
2
H
4
7) As
4
O
6
8) 207,6 g/mol.
9) 54,6%.
10) 5,13%.
11) 7
12) N
2
O
4
13) MgCl
2
O
8
14) C
2
H
6
O
15) K
3
Co(NO
2
)
6
Arkusz 2.
1) 0,39 g Fe, 0,36 g Al
2) 0,6 g HNO
3
i 12,8 g NaNO
3
.
3) 4,68 g
4) 12,9 g
5) 88,8 g, 994 dm
3
6) 28,5% CaCO
3
, 71,5% CaO
7) 27,6% Cu, 72,4% Ag
8) siarka
9) 50,6%NaCl, 49,4% KCl
10) C
6
H
7
N
11) 1,57 dm
3
, 7,6% H
2
, 92,4% H
2
S
12) 5,62 dm
3
, 3,06 dm
3
13) chlor, 0,6205 g HCl
Arkusz 3.
1) 8,0 mol/dm
3
.
2) 1,43 mol/dm
3
.
3) 0,76 mol/dm
3
HNO
3
4) 9,31%, 1,8 mol/dm
3
.
5) H
2
SO
4
, 0,056 mol/dm
3
, 0,002 mol
6) 216 cm
3
, 228 cm
3
, 4,23 mol/dm
3
.
7) 183 cm
3
.
8) 919,5 cm
3
, 1134 cm
3
.
9) 0,725 dm
3
.
10) 0,745 dm3 i uzupełnić wodą.
11) 0,08 dm
3
.
12) 0,073 dm
3
.
13) 16,7 g
14) 62,07 cm
3
.
15) 43,0%, 5,81 mol/dm
3
.
Arkusz 4
1) 21,6 dm
3
.
2) 12,62
3) 0,024 mol/dm
3
,
4) 1,5 cm
3
5) 2,22
6) pH = 3,9; 0,14
7) zmaleje o 2,00
8) 0,0053 mol/dm
3
,
9) 6,3 * 10
-9
10) 0,56; 0,44,
11) 1,49 – 1,40, 2,43 – 2,40
12) 1,92
13) 0,28 mol/dm
3
,
14) 1,0 * 10
-6
mol/dm
3
,
15) 12,66
Arkusz 5
1) a) bez zmian b) zmaleje o 0,12, c) zmaleje o 0,03
2) a) zmaleje o 0,08, b) bez zmian
3) 4,79
4) 9,92
5) 4,60
6) 7,77 g
7) wzrośnie o 0,35
8) wzrośnie o 0,44
9) wzrośnie 2,2 razy
10) 11,50
11) 5,14
12) 7,1 * 10
-11
13) 9,00, 9,23, 8,73
14) a)wzrośnie o 0,06 , b) wzrośnie o 0,27
Wyszukiwarka
Podobne podstrony:
MateriaĹ y dla studentĂlw PL 12 13
Materiały dla studentów ENDOKRYNOLOGIA
materiały dla studentów 8
Socjalizm utopijny, Materiały dla studentów WSB DG
Test z Monitoringu Biologicznego, Materiały dla studentów, ochrona srodowiska
materialy dla studentow polisac Nieznany
Materiały dla studentów Studiów Podyplomowych, Edukacja wczesnoszkolna, edukacja wczesnoszkolna, na
RYTMY BIOLOGICZNE, MATERIAŁY dla STUDENTÓW, 500 PRAC (pedagogika, psychologia, socjologia, filozofia
Materiały dla studentów 5, PeDaGoGiKaa
c.d. materiałów dla studentów- komunikacja werbalna i asertywność, Pedagogika w zakresie edukacji do
technologia drążenia wyrobisk korytarzowych materiały dla studentów
Hydrologia sciągaaaaaaaaa, Materiały dla studentów, ochrona srodowiska
Metodologia badań-materiały dla studentów, szkoła, MiTBS, metodologia badań
więcej podobnych podstron