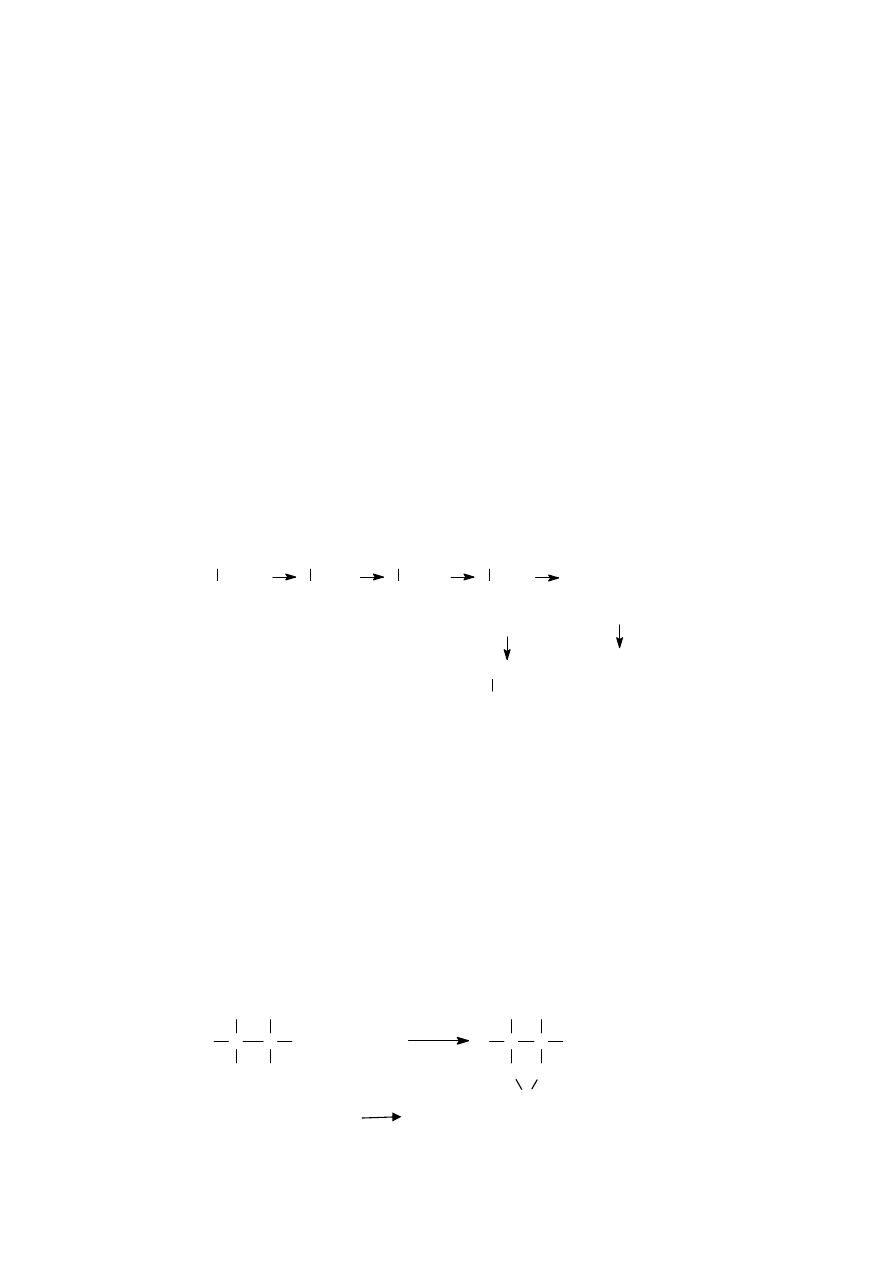
INSTRUKCJA DO ĆWICZEŃ:
„ANALIZA WYBRANYCH SUBSTANCJI TOKSYCZNYCH”
1. Wykrywanie glikolu etylenowego
Glikol etylenowy jest bezbarwną, oleistą cieczą, o słodkawym smaku, mieszającą się
dobrze w każdym stosunku z wodą. Znajduje on zastosowanie w wielu produktach
powszechnego użytku np. jako rozpuszczalnik celulozy i niektórych farb. Wchodzi w skład
preparatów przeciw zamarzaniu szyb, płynów do chłodnic, tuszów do stempli oraz żywic
syntetycznych. Ostre zatrucie glikolem powstaje wyłącznie po wchłonięciu z przewodu
pokarmowego.
Przemiany metaboliczne glikolu etylenowego w organizmie prowadzą do powstania kwasu
szczawiowego, odpowiedzialnego za występujące w ostrych zatruciach zmiany w nerkach i
występującą zawsze bardzo głęboką kwasicę metaboliczną. Część glikolu wydala się z
moczem w formie nie zmienionej. Mniej niż 2% wydala się w postaci kwasu szczawiowego.
Z powietrzem wydychanym wydala się w postaci dwutlenku węgla w ilości 60% w ciągu 3
dni. Wydalanie kwasu szczawiowego przebiega bardzo wolno i trwa od 2 do 6 tygodni.
Za działanie toksyczne odpowiedzialny jest również kwas glioksalowy i glikolowy oraz inne
kwasy organiczne (patrz ryc.1).
Ryc. 1. Metabolizm glikolu
Glikol etylenowy działa narkotycznie oraz ma dużą zdolność do rozprzestrzeniania się
w różnych tkankach i narządach. Gromadząc się w płynie mózgowo-rdzeniowym, może
wywołać ciężkie uszkodzenie ośrodkowego układu nerwowego.
Wykonanie ćwiczenia:
Do badanego płynu dodaje się w nadmiarze 10% roztwór wodorotlenku sodu i
kroplami 10% roztwór siarczanu miedzi. Powstający wodorotlenek miedziowy tworzy z
glikolem związek rozpuszczalny w wodzie, o zabarwieniu niebieskim
2 NaOH + CuSO
4
Na
2
SO
4
+ Cu(OH)
2
C
C
H
H
H
OH
H
OH
+
Cu(OH)
2
H
C
C
H
H
H
O
O
Cu
+
2H
2
O
niebieski
CH
2
OH
CH
2
OH
CH
2
OH
CHO
CH
2
OH
COOH
CHO
COOH
COOH
COOH
HCOOH
glikol
etylenowy
aldehyd
glikolowy
kwas
glikolowy
kwas
glioksalowy
kwas
mrówkowy
kwas
szczawiowy
CO
2 +
H
2
O

2. Wykrywanie metanolu – próba kroplowa
Alkohol metylowy dobrze wchłania się przez drogi oddechowe oraz przez skórę
(główna przyczyna zatruć w przemyśle), a także przez przewód pokarmowy i błony śluzowe.
Jest bardzo silna trucizną, nieporównywalnie silniejszą od alkoholu etylowego. Tę dużą
toksyczność potęguje fakt, że metanol kumuluje się w ustroju, osiągając w tkankach znacznie
wyższe stężenie, a jego eliminacja z krwi przebiega czterokrotnie wolniej niż etanolu. W
pierwszym etapie metabolizmu metanol ulega przemianie do aldehydu mrówkowego pod
wpływem dehydrogenazy alkoholowej, następnie przechodzi w kwas mrówkowy i dalej
zostaje utleniony do CO
2
i H
2
O. Aldehyd i kwas mrówkowy są odpowiedzialne za
uszkadzanie nerwu wzrokowego, co w następstwie często prowadzi do ślepoty
.
Alkohol metylowy znacznie silniej działa toksycznie niż etylowy, łatwiej więc może
doprowadzić do porażenia ośrodka oddechowego.
Wystąpienie objawów zatrucia metanolem może mieć miejsce nawet w dobę
po jego
spożyciu. Pierwsze objawy to bóle głowy, nudności, wymioty, osłabienie. W dalszym
przebiegu zatrucia pojawiają się zaburzenia widzenia, potem sinica, śpiączka, zapaść i
śmierć.
Wykonanie ćwiczenia:
We wgłębieniu płytki porcelanowej umieścić kryształek kodeiny a następnie zwilżyć 1
kroplą stężonego H
2
SO
4
. Do probówki odmierzyć 3 krople badanego roztworu a następnie 15
kropli stężonego H
2
SO
4
. Probówkę ochłodzić w łaźni z zimną wodą. Odmierzyć 3 krople tak
sporządzonego roztworu do dołka gdzie znajdowała się kodeina. Powstająca po czasie barwa
niebieska w dołku wskazuje na obecność metanolu
3. Paracetamol – wykrywanie w badanej próbce
Paracetamol (acetaminofen) jest stosowany sam lub w skojarzeniu z innymi lekami
w złożonych lekach przeciwbólowych i przeciwgorączkowych. Zatrucie paracetamolem staje
się coraz częstsze.
Paracetamol w dawkach toksycznych może uszkadzać wątrobę, nerki, serce oraz
ośrodkowy układ nerwowy. Zażycie ponad 4 gramów paracetamolu/ dobę powoduje
nudności, wymioty, senność, zaburzenia świadomości, tkliwość wątroby i żółtaczkę. Rozwija
się ostra niewydolność wątroby i nerek. Zgony z powodu martwicy wątroby notowano do 2
tygodni po zatruciu.
Wykonanie ćwiczenia:
Około 0,1 g substancji wytrząsnąć z 2 ml gorącej wody i dodać 0,1 ml świeżo
przygotowanego roztworu chlorku żelaza(III) (nie mieszać). Powstaje niebieskofioletowe
zabarwienie
4. Spektrofotometryczne oznaczanie jonów azotanowych (III) w wodzie metodą Griessa
Azotany (III) i azotany (V) zaliczane są do toksycznych związków, które mogą
występować jako zanieczyszczenia w środowisku i żywności.
W przewodzie pokarmowym azotany (III) podlegają zarówno procesowi wchłaniania jak i
przemianom między innymi do nitrozoamin, które mogą powodować zmiany nowotworowe
najczęściej w żołądku, przełyku, wątrobie, płucach, nerkach oraz w pęcherzu moczowym.
Szkodliwość azotanów (III) (NO
2
-
) wynika również z powodowanego przez ten związek
utleniania hemoglobiny i mioglobiny do methemoglobiny i metmioglobiny oraz rozszerzenia
naczyń krwionośnych i obniżenia ciśnienia krwi. Z tego powodu w skrajnych przypadkach
zbyt wysokie stężenie azotanów (III) w pożywieniu może prowadzić nawet do śmierci
niemowląt. Azotany (III) destrukcyjnie oddziaływują także na witaminy z grupy A i B oraz
karotenoidy.
W UE obowiązują bardzo ostre normy dotyczące zawartości azotanów w żywności
przeznaczonej dla niemowląt i dzieci. Według przyjętych norm zawartość azotanów nie może
przekroczyć 200 miligramów na kilogram świeżej masy.
Azotany (III) reagują w środowisku kwaśnym z I-rzędową aminą aromatyczną,
tworząc sól diazoniową, która może ulec reakcji sprzęgania z fenolem lub aminą
aromatyczną. Tworzący się w wyniku tej reakcji barwnik azowy stanowi podstawę
spektrofotometrycznego oznaczania azotanów (III).
Odczynniki:
1. Odczynnik 1 to roztwór wodny zawierający H
3
PO
4
(stęż. 85%), amid kwasu
sulfanilowego i dichlorowodorek N-(1-naftylo)etylenodiaminy C
12
H
16
Cl
2
N
2
.
2. Roztwór wzorcowy R zawiera 0,25mg N (w NO
2
–
) w 1dm
3
.
Wykonanie ćwiczenia:
A. Przygotować w probówkach (w dwóch powtórzeniach) roztwory zawierające:
1. 5ml wody destylowanej
2. 1ml roztworu R + 4ml wody destylowanej
3. 3ml roztworu R + 2ml wody destylowanej
4. 5ml roztworu R
B. Do każdej probówki odpipetować 0,2 ml odczynnika 1, zawierającego H
3
PO
4
, amid
kwasu sulfanilowego, dichlorowodorek N-(1-naftylo)etylenodiaminy. Wymieszać.
C. Pozostawić roztwory na 10min.w temp. pokojowej
D. Zmierzyć przy użyciu spektrofotometru absorbancję próbek 2, 3 i 4 przy długości fali
światła = 542 nm względem próby ślepej (roztwór 1 nie zawierający jonów NO
2
-
)
E. Uśrednić wyniki dwóch odczytów absorbancji. Obliczyć stężenia N (w mg/dm
3
) w
próbkach 2 i 3 (w próbce 4 roztwór R pozostaje nierozcieńczony) korzystając ze wzoru C
1
V
1
= C
2
V
2
.
Sporządzić na papierze milimetrowym wykres zależności absorbancja/stężenie N (mg/dm
3
).
F. Badaną próbkę wody przygotować analogicznie jak próbki wzorcowe:
Pobrać 5ml badanej wody wodociągowej + 0,2 ml odczynnika 1, wymieszać, pozostawić
na 10min. Zmierzyć absorbancję względem próby ślepej, a następnie z krzywej kalibracji
odczytać jakie jest stężenie N w NO
2
-
w badanej próbce wody.
Wyszukiwarka
Podobne podstrony:
instrukcja do cwiczenia t1 dla Nieznany
Instrukcja do cwiczenia 1 2 3 E Nieznany
instrukcja do cwiczenia nr 23 i Nieznany
Instrukcja do cwiczenia id 2165 Nieznany
Instrukcja do cwiczenia 1
Instrukcje do ćwiczeń 2013
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Biofizyka instrukcja do cw nr 0 Nieznany (2)
INSTRUKCJA do ćwiczenia pomiar temperatury obrabiarek v3 ver robocza
instrukcja 06, sem 3, Podstawy elektrotechniki i elektroniki, Laboratoria, instrukcje do cwiczen 201
Instrukcja do cwiczenia 2
Odpowiedzi do cwiczen English P Nieznany
cw 10 instrukcja do moska Whe Nieznany
Instrukcja do ćwiczenia laboratoryjnego PDH
instrukcja 09, sem 3, Podstawy elektrotechniki i elektroniki, Laboratoria, instrukcje do cwiczen 201
Instrukcja do ćwiczenia8
Instrukcja do ćwiczenia(8)
więcej podobnych podstron